Daftar isi
Pengertian Sistem Koloid
Koloid berasal dari bahasa Yunani yaitu, “kolla” yang berarti lem dan “oid” yang berarti seperti. Nama koloid diberikan oleh Thomas Graham pada tahun 1861.
Sistem koloid merupakan campuran heterogen yang keadaannya terletak antara larutan dan suspensi (campuran kasar). Koloid memiliki ukuran partikel berkisar antara 1 sampai 100 nanometer.
Untuk lebih jelasnya simak tabel perbandingan antara larutan, koloid, dan suspensi berikut.
| Larutan | Koloid | Suspensi |
| Homogen | Heterogen (diamati dengan mikroskop ultra) | Heterogen |
| Dimensi partikel < 1 nm | Dimensi partikelnya antara 1 – 100 nm | Salah satu atau semua dimensi partikelnya > 100 nm |
| Satu fase | Dua fase | Dua fase |
| Stabil | Pada umumnya stabil | Tidak stabil |
| Tidak dapat disaring | Dapat disaring dengan penyaring ultra | Dapat disaring |
| Contoh : Larutan gula, larutan garam, larutan cuka | Contoh : Susu, santan, sabun | Contoh : Campuran air dan pasir, kopi dan air |
Jenis-Jenis Koloid
Koloid terdiri dari 2 fase yaitu:
- Fase terdispresi, yaitu zat yang didispersikan.
- Medium dispersi atau fase pendispersi, yaitu medium yang digunakan untuk mendispresikan zat.
| Jenis koloid | Fase terdispersi | Fase pendispersi | Contoh |
| Aerosol | Cair | Gas | Kabut dan awan, hairspray |
| Aerosol padat | Padat | Gas | Asap, debu di udara |
| Emulsi | Cair | Cair | Susu, santan, minyak ikan |
| Emulsi padat | Cari | Padat | Jeli, mutiara, keju |
| Sol | Padat | Cair | Tinta, cat |
| Sol padat | Padat | Padat | Gelas berwarna, intan hitam |
| Buih | Gas | Cair | Busa sabun, krim kocok |
| Buih padat | Gas | Padat | Karet busa, batu apung, styrofoam |
Sifat-Sifat Koloid
1. Efek Tyndall
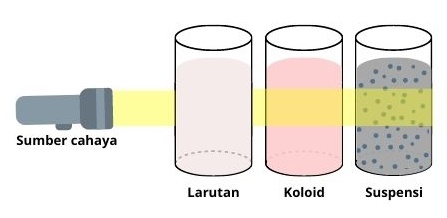
Efek penghamburan cahaya oleh partikel koloid sehingga jejak cahayanya dapat terlihat, sedangkan larutan sejati bersifat meneruskan cahaya sehingga jejaknya tak terlihat.
Contoh efek Tyndall dalam kehidupan sehari-hari yaitu sorot lampu mobil pada malam hari saat berkabut.
2. Gerak Brown
Gerak Brown yaitu suatu gerak zig-zag (tidak beraturan) partikel koloid yang dapat diamati dibawah mikroskop ultra.
Gerak Brown inilah yang membuat koloid stabil dan tidak mengalami sedimentasi karena partikelnya yang bergerak terus menerus.
Larutan juga mengalami gerak Brown namun tidak dapat diamati, sedangkan suspensi tidak terjadi gerak Brown karena ukuran partikelnya besar.
3. Elektroforesis
Elektroforesis adalah pergerakan partikel koloid dalam medan listrik. Koloid bermuatan negatif akan bergerak ke elektroda positif (anoda) sedangkan koloid bermuatan positif bergerak ke elektroda negatif (katoda).
4. Adsorpsi
Partikel koloid memiliki kemampuan menyerap berbagai macam zat pada permukaannya. Sifat adsorpsi ini digunakan dalam proses pemutihan gula tebu, penjernihan air, dan obat norit.
5. Koagulasi
Koloid dapat mengalami koagulasi/penggumpalan apabila muatannya dilucuti, hal ini karena kestabilannya akan berkurang. Pelucutan muatan koloid dapat terjadi pada sel elektroforesis atau jika elektrolit ditambahkan ke dalam sistem koloid.
Pembentukan delta di muara sungai merupakan contoh koagulasi dalam kehidupan sehari-hari. Koloid tanah liat dalam air sungai mengalami koagulasi ketika bercampur dengan elektrolit dalam air laut.
6. Koloid Pelindung
Koloid pelindung adalah koloid yang ditambahkan pada koloid lain untuk membungkus partikel zat terdispersi sehingga koloid akan lebih stabil dan tidak mengelompok.
Contoh koloid pelindung yaitu penggunaan gelatin pada pembuatan es krim untuk mencegah pembentukan kristal besar es atau gula.
7. Dialisis
Dialisis adalah proses penyaringan dengan tujuan menghilangkan ion-ion yang mengganggu kestabilan koloid. Proses ini dilakukan dengan memasukkan sistem koloid ke dalam kantung koloid.
Kantung koloid terbuat dari selaput semipermeable, yaitu selaput yang dapat dilewati oleh partikel kecil seperti ion atau molekul sederhana, tetapi dapat menahan partikel koloid.
8. Koloid Liofil dan Koloid Liofob
Koloid yang medium pesdispersinya cair dibedakan atas koloid liofil dan koloid liofob. Jika medium pendispersinya adalah air maka disebut koloid hidrofil dan koloid hidrofob.
Apabila gaya tarik menarik antara zat terdispersi dengan medium pendispersinya cukup besar maka disebut koloid liofil.
Sebaliknya, jika gaya tarik menarik tersebut tidak ada atau sangat lemah maka disebut koloid liofob.
Berikut perbedaan koloid liofil dan koloid liofob:

Cara Pembuatan Koloid
Cara Kondensasi
Cara kondensasi yaitu pengelompokkan partikel larutan sejati. Cara kondensasi dilakukan secara:
- Reaksi redoks
Contoh : Pembuatan sol belerang dari reaksi antara hidrogen sulfida (H2S) dengan belerang dioksida (SO2), yaitu dengan mengalirkan gas H2S ke dalam larutan SO2.
2H2S(g) + SO2(aq) --> 2H2O(l) + 3S(koloid)
- Hidrolisis
Contoh : Pembuatan sol Fe(OH)3 dari hidrolisis FeCl3. Apabila ke dalam air mendidih ditambahkan larutan FeCl3, akan terbentuk sol Fe(OH)3.
FeCl3(aq) + 3H2O(l) --> Fe(OH)3(koloid) + 3HCl(aq)
- Dekomposisi Rangkap
Contoh : Sol AgCl dapat dibuat dengan mencampurkan larutan perak nitrat encer dengan larutan HCl encer.
AgNO3(aq) + HCl(aq) --> AgCl(koloid) + HNO3(aq)
- Penggantian Pelarut
Contoh : Apabila larutan jenuh kalsium asetat dicampur dengan alkohol akan terbentuk suatu koloid berupa gel.
Cara Dispersi
Cara dispersi yaitu menghaluskan bahan dalam bentuk kasar kemudian didispersikan ke dalam medium dispersi.
Dengan cara dispersi, partikel kasar dipecah menjadi partikel koloid. Cara dispersi dapat dilakukan secara:
- Cara Mekanik
Menurut cara ini butir-butir kasar digerus dengan penggiling atau lumpang hingga diperoleh tingkat kehalusan tertentu kemudian dicampur dan diaduk dengan medium pendispersinya.
Contoh : Sol belerang dibuat dengan menggerus serbuk belerang bersama dengan suatu zat inert (seperti gula pasir), kemudian serbuk halus tersebut dicampur dengan air.
- Cara Peptisasi
Cara peptisasi adalah pembuatan koloid dari butir kasar atau endapan dengan bantuan zat pemecah.
Contoh : Agar-agar dipeptisasi oleh air, nitroselulosa oleh aseton, karet oleh bensin, dll.
- Cara Busur Bredig
Cara busur Bredig merupakan gabungan cara dispersi dan kondensasi. Cara ini digunakan untuk membuat sol-sol logam.
Logam yang akan dijadikan koloid digunakan sebagai elektroda yang dicelupkan ke dalam medium pendispersi, kemudian diberi loncatan listrik di antara kedua ujungnya.
Awalnya atom-atom logam akan terlempar ke dalam air, lalu atom-atom tersebut mengalami kondensasi sehingga membentuk partikel koloid.
