Daftar isi
Pada pembahasan kali ini, akan dilanjutkan dengan larutan elektrolit dan non elektrolit.
Larutan ini umumnya dibagi menjadi larutan yang menghantarkan listrik dan tidak menghantarkan listrik. Penjelasan lebih mendetail dapat dilihat di bawah ini.
Larutan Elektrolit
Pengertian Larutan Elektrolit
Larutan elektrolit adalah larutan yang mampu menghantarkan listrik. Larutan yang mampu menghantarkan listrik dapat dilihat gejalanya seperti mampu menyalakan lampu dengan menggunakan alat uji atau pada larutan menghasilkan gelembung gas.
Larutan elektronik dibagi menjadi dua jenis yaitu:
- Lauratan elektrolit kuat
- Larutan elektrolit lemah
Sifat-sifat Larutan Elektrolit
Berikut beberapa sifat yang dimiliki oleh larutan elektrolit
- Penghantar listrik yang baik
- Mampu menghasilkan gelembung, dan menyalakan lampu
- Memiliki derajat ionisasi mendekati 1 atau tepat 1
- Umumnya larutan elektrolit merupakan basa kuat atau asam kuat.
Senyawa Pembentuk Larutan Elektrolit
Senyawa pembentuk larutan elektrolit terdiri menjadi dua jenis yaitu senyawa ion dan senyawa kovalen. Berikut penjelasan masing-masing senyawa pembentuk.
1. Senyawa Ion
Senyawa ion adalah senyawa dengan ion-ion yang dapat bergerak bebas ke larutan.
Salah satunya contohnya adalah NaCl atau lebih dikenal dengan garam. Pada saat dilarutkan, ion positif akan terpisah dengan larutan ion negatif.
Berikut persamaan kimia pelarutan garam pada air
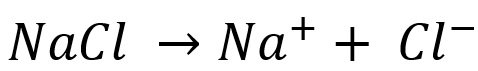
2. Senyawa Kovalen
Senyawa kovalen adalah senyawa yang memiliki atom dengan ikatan kovalen.
Senyawa kovalen yang terdapat pada larutan elektrolit adalah ikatan kovalen sempurna dimana senyawa yang terbentuk dari dua atom memiliki perbedaan keelektronegatifan.
Contoh senyawa kovalen polar antara lain asam klorida, asam cuka murni, dan larutan ammonia.
Meski bukan senyawa elektrolit yang kuat, larutan tersebut cukup baik dalam menghantarkan lisrtik jika dilarutkan dalam air karena HCl merupakan senyawa polar sehingga akan menghasilkan listrik jika bergabung dengan air.
Jenis Larutan Elektrolit
1. Larutan Elektrolit Kuat
Larutan elektrolit kuat adalah larutan yang dapat menyalakan lampu dengan terang dan menghasilkan gelembung gas yang banyak.
Larutan elektrolit kuat mengalami ionisasi sempurna sehingga derajat ionisasinya adalah 1.
Larutan elektrolit kuat dapat terbentuk dari terlarutnya senyawa elektrolit kuat pada pelarut air.
Senyawa elektrolit kuat terurai sempurna di dalam air dengan membentuk kation yaitu ion positif dan anion yaitu ion negatif.
Arus listrik yang di lewatkan melalui larutan elektrolit kuat akan menghantarkan ion dalam larutan.
Oleh karena itu lampu dapat menyala ketika dilakukan percobaan.
Beberapa contoh larutan elektronik kuat yaitu HCl, air, air laut, air aki, dan air kapur.
2. Larutan Elektrolit Lemah
Larutan elektrolit lemah adalah larutan yang tidak mampu menyalakan lampu saat uji coba namun mampu menghasilkan gelembung gas.
Larutan elektrolit lemah tidak mengalami ionisasi yang sempurna sehingga derajat ionisasinya berada di antara 0 < a < 1
Beberapa contoh larutan elektrolit lemah adalah ammonia, H2S, dan larutan cuka.
Larutan Non Elektrolit
Pengertian Larutan Non Elektrolit
Larutan non elektrolit adalah larutan yang tidak bisa menghantarkan arus listrik dan tidak menghasilkan gelembung dalam larutan karena tidak menghasilkan ion-ion.
Beberapa larutan yang termasuk non elektrolit adalah urea, glukosa, sukrosa, dan etanol.
Sifat-sifat Larutan Non Elektrolit
Berikut beberapa sifat larutan non elektrolit yang membedakannya dengan larutan elektrolit
- Tidak dapat melakukan ionisasi
- Tidak mampu menghantarkan arus listrik
- Memiliki derajat ionisasi a = 0
- Tidak menghasilkan arus listrik dan gelembung gas dalam larutan air.
Perbedaan Larutan Elektrolit dan Non Elektrolit
Perbedaan larutan elektrolit dan non elektrolit dapat dilihat pada tabel di bawah ini.

Secara umum larutan elektrolit dan non elektrolit berbeda pada kemampuannya dalam menghantarkan arus listrik dan sifat dari masing-masing larutan.
