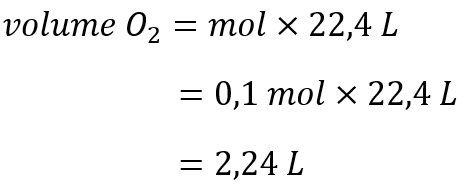Daftar isi
Pada pelajaran kimia kali ini akan dibahas tentang stoikiometri. Sebagai contoh, jika kita akan melakukan pemupukan tanaman, pupuk harus memiliki konsentrasi yang tepat.
Tidak boleh terlalu pekat atau pun encer. Nah, pembahasan tentang stoikiometri kurang lebih demikian.
Pengertian Stoikiometri
Stoikiometri didefinisikan sebagai ilmu kimia yang membahas tentang kuantitas pada zat yang terdiri dari massa, jumlah mol, volume, dan jumlah partikelnya.
Pada materi ini pembahasan akan lebih fokus pada perbandingan mol, jumlah partikel, dan volume. Rumus yang digunakan pada stoikiometri adalah

Dasar Stoikiometri
1. Stoikiometri Larutan
Stoikiometri larutan atau lebih dikenal dengan konsentrasi larutan adalah istilah yang menyatakan jumlah zat yang terlarut ke dalam sejumlah pelarut.
Konsentrasi larutan dinyatakan dengan molaritas. Molaritas didefinisikan sebagai jumlah mol zat terlarut untuk per liter larutan. Rumusnya adalah sebagai berikut

2. Stoikiometri Gas Ideal
Stoikiometri gas atau juga dikenal dengan volume molar didefinisikan sebagai volume dari 1 mol entitas yang terdiri dari atom, ion, molekul dan unit formula dari suatu materi.
Satuan untuk volum molar adalah L/mol. Berikut rumus stoikiometri gas.
Jenis-jenis Stoikiometri
Stoikiometri dibagi menjadi tiga jenis yaitu:
- Stoikiometri komposisi
- Stoikiometri gas
- Stoikiometri reaksi
Penjelasan untuk masing-masing jenis stoikiometri dibahas di bawah ini.
1. Stoikiometri Reaksi
Pada persamaan kimia, stoikiometri reaksi digunakan untuk menyeimbangkan persamaan kimia. Hal ini berkaitan dengan hubungan kuantitatif antara zat pereaksi dan zat produk. Zat pereksi adalah zat yang digunakan untuk menghasilkan zat pada reaksi kimia. Sedangkan zat produk adalah zat yang dihasilkan dari reaksi kimia.
2. Stoikiometri Komposisi
Stoikiometri komposisi adalah hubungan kuantitatif antara masing-masing unsur dalam senyawa. Dalam stoikiometri komposisi digunakan untuk mengetahui jumlah massa pada reaksi yang memiliki persamaan yang setimbang karena adanya hubungan mol dengan massa atom.
3. Stoikiometri Gas
Stoikiometri ini berkaitan dengan reaksi dimana gas, tekanan, dan volume memiliki peran dalam menghasilkan gas ideal. Rasio volume ideal untuk gas sama dengan hukum gas ideal. Pada praktiknya, massa molar digunakan sebagai ganti menghitung rasio massa pada stoikiometri gas.
Contoh soal dan Pembahasan
Berikut beberapa soal stoikiometri yang dapat dipelajari untuk membantu memahami materi kali ini
1.Pada suatu reaksi kimia, propane dibakar dengan persamaan berikut
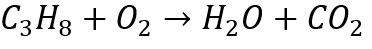
Jika 200 gram Propana dibakar, berapa jumlah H2O yang akan terbentuk?
Jawab:
Hitung mol C3H8
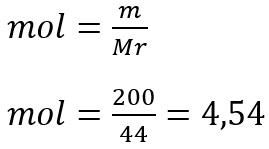
Hitung rasio H2O

Hitung mol H2O

Konversi dari mol ke gram
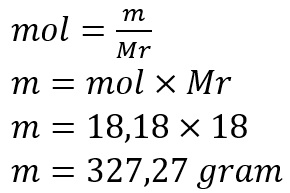
2.Perhatikan persamaan reaksi kimia berikut

Jika gas SO2 sebanyak 12,8 gram, maka berapa volume gas O2 dan massaSO3 yang akan terbentuk?
Jawab:
Hitung massa molekul relatif O2 dan SO2
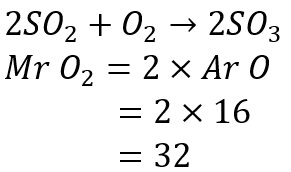
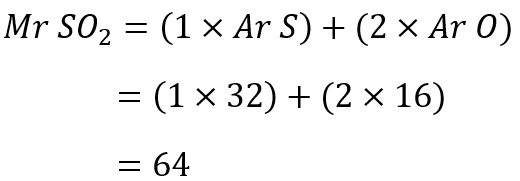
Hitung mol gas SO2 dan O2
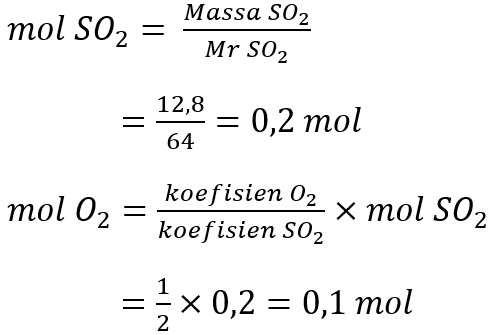
Volume O2 adalah