Daftar isi
Setelah mempelajari hukum dasar kimia, kali ini kita akan mempelajari hukum avogadro. Berikut penjelasannya.
Apa itu Hukum Avogadro?
Hukum Avogadro merupakan suatu hukum gas eksperimen yang mengaitkan antara volume gas dengan jumlah zat gas tersebut. Hukum ini merupakan kasus hukum gas ideal yang spesifik.
Sejarah Penemuan Hukum Avogadro
Hukum Avogadro berawal dari hipotesis seorang ilmuwan dari Italia yang bernama Amedeo Avogadro pada tahun 1811.
Hukum Avogadro memiliki korelasi dengan hukum Gay Lussac tentang perbandingan volume unsur atau senyawa pereaksi dan hasil reaksi sesuai dengan perbandingan koefisiennya.
Hukum Avogadro ini kemudian dikembangkan lagi sehingga hukum Gay Lussac dapat dikaitkan dengan jumlah molekul.
Hukum Gay Lussac memiliki kesimpulan bahwa perbandingan volume gas yang bereaksi dan volume gas yang dihasilkan reaksi adalah perbandingan bilangan bulat, dan pada temperatur dan tekanan yang sama.
Penemuan Gay Lussac dikenal sebagai hukum perbandingan berganda.
Kemudian muncul pertanyaan mengapa pada tekanan dan temperatur yang sama, perbandingan volume gas yang bereaksi dan hasil reaksi merupakan perbandingan bilangan bulat dan sederhana?
Pertanyaan tersebut dijawab melalui hukum Avogadro yang diperkenalkan oleh Amedeo Avogadro melalui percobaan yang telah dilakukannya.
Bunyi Hukum Avogadro
Hipotesis Avogadro berbunyi:
“Gas-gas yang memiliki volume yang sama dan pada temperatur dan tekanan yang sama juga memiliki jumlah partikel yang sama“.
Berawal dari menjawab hukum Gay Lussac maka munculah hukum Avogadro yang berbunyi:
“Pada temperatur dan tekanan yang sama, volume yang sama dari semua gas mengandung jumlah molekul yang sama”.
Percobaan yang dilakukan Avogadro menyimpulkan pembentukan 2 molekul uap air dari reaksi antara 2 molekul gas hidrogen dan 1 molekul gas oksigen.
Karena perbandingan volume gas hidrogen, gas oksigen, dan uap air pada reaksi pembentukan uap air adalah 2 : 1 : 2.
Maka perbandingan jumlah molekul hidrogen, oksigen, dan uap air menjadi demikian, 2 : 1 : 2.
Jumlah atom pada tiap unsur tidak berkurang atau bertambah dalam reaksi kimia.
Sehingga molekul gas hidrogen dan molekul gas oksigen harus merupakan molekul dwiatom, sedangkan molekul uap air harus merupakan molekul triatom.
Rumus Hukum Avogadro
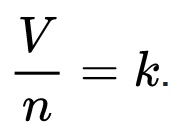
Keterangan:
V = volume gas.
n = jumlah mol pada gas tersebut.
k = tetapan kesebandingan.
Konstanta gas ideal memiliki nilai yang sama bagi semua gas.
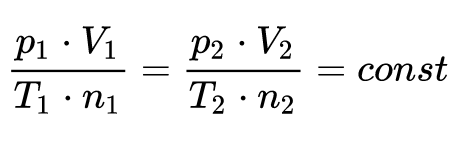
Keterangan:
p1 = tekanan gas
T1 = temperatur.
Artinya konstanta mempunyai nilai yang sama pada semua gas dan tidak bergantung pada ukuran ataupun massa molekul gas.
Hipotesis Avogadro telah dibuktikan melalui teori kinetika gas.
Satu mol pada gas ideal memiliki volum 22.4 liter pada kondisi standar (STP), jumlah ini juga disebut volum molar gas ideal. Gas-gas nyata (non-ideal) memiliki nilai yang berbeda.
Bilangan Avogadro yang memiliki lambang L atau NA, disebut juga sebagai ketetapan Avogadro atau bisa juga disebut konstanta Avogadro.
Bilangan Avogadro menunjukkan banyaknya “entitas” (atom atau molekul) di dalam satu mol .
Merupakan jumlah atom karbon-12 dalam 12 gram (0,012 kilogram) karbon-12 dalam keadaan dasarnya. Perkiraan terbaik terakhir untuk angka ini yaitu:
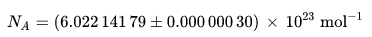
Nilai ini sangat dekat (hanya berbeda 0.37% lebih kecil) dibandingkan 279 mol−1, angka ini juga berguna sebagai perkiraan pada fisika nuklir untuk menghitung laju pertumbuhan reaksi berantai.
Contoh Soal dan Pembahasan
Soal 1
Reaksi N2(g) + 3 H2(g)→ 2 NH3(g). Jika pada 1 liter gas N2 terdapat n molekul.
Hitunglah jumlah molekul H2 yang bereaksi dan jumlah molekul NH3 yang terbentuk jika reaksi berlangsung pada temperatur dan suhu yang sama.
Jawab:
Perbandingan volume N2 : H2 : NH3 = 1 : 3 : 2 menunjukkan perbandingan molekul, jika N2 ada n molekul maka
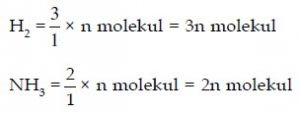
Soal 2
1 liter gas hidrogen bereaksi dengan 1 liter gas klorin, sehingga dihasilkan 2 liter gas hidrogen klorida. Jika gas hidrogen yang direaksikan 5 liter, tentukan gas hidrogen klorida yang dihasilkan!
Jawaban:
menggunakan perbandingan berikut dengan anggapan suhu dan tekanan tidak berubah.
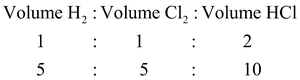
Volume gas hidrogen klorida yang dihasilkan adalah 10 liter.
Soal 3
Sebuah besi memiliki massa 21 gram direaksikan dengan belerang sehingga membentuk 33 gram besi belerang. Tentukan massa belerang yang bereaksi!
Jawaban:
Sebelum menentukan massa belerang yang bereaksi, tentukan persamaan reaksinya.

Hukum Lavoisier menyatakan bahwa massa zat sebelum dan setelah reaksi adalah sama, sehingga diperoleh:
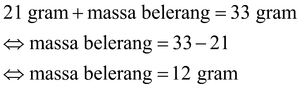
Jadi, massa belerang yang bereaksi adalah 12 gram.
Soal 4
Pada suhu dan tekanan tertentu, gas N2 direaksikan dengan gas H2 menjadi gas NH3. Jika gas H2 yang bereaksi sebanyak 7,5 × 1023 molekul, berapakah jumlah molekul NH3 yang terbentuk?
Jawaban:
Pada suhu dan tekanan yang sama, gas-gas yang volumenya sama akan mengandung jumlah molekul yang sama (menurut Avogadro).
Koefisien reaksi menyatakan perbandingan volume gas-gas yang bereaksi (menurut Gay Lussac).
Persamaan reaksi kimia dari reaksi N2 dan H2 dapat dituliskan sebagai berikut:
H2(g) + N2(g) → NH3(g) [belum setara]
3H2(g) + N2(g) → 2NH3(g) [setara]
Dari soal diketahui bahwa gas H2 yang bereaksi sebanyak 7,5 × 1023 molekul dan berdasarkan persamaan reaksi kimia di atas, koefisien H2 adalah 3.
Hal ini mengandung pengertian bahwa dalam 3 volume H2 terkandung 7,5 × 1023 molekul maka dalam 2 volume NH3 terkandung:
⇔ (2 volume NH3/3 volume H2) × 7,5 × 1023 molekul H2
⇔ (2/3) × 7,5 × 1023 = 5,0 × 1023
Jadi, jumlah molekul NH3 yang terbentuk adalah sebanyak 5,0 × 1023 molekul.
Soal 5
Pada pembakaran 5 liter (T, P) alkohol menurut reaksi:
C2H5OH(g) + O2(g) → CO2(g) + H2O(l)
Tentukan volume oksigen (T, P) dan volume gas karbon dioksida (T, P)!
Jawaban:
5 L alcohol (C2H5OH) dibakar menurut persamaan reaksi:
C2H5OH(g) + O2(g) → CO2(g) + H2O(l)
Reaksi setara untuk pembakaran alkohol adalah:
2C2H5OH(g) + 7O2(g) → 4CO2(g) + 5H2O(l)
V C2H5OH : VO2 : VCO2 : VH2O = 2 : 7 : 4 : 5
Untuk mencari volume oksigen maka kita pakai perbandingan alkohol dan oksigen.
V C2H5OH : VO2 = 2 : 7
V O2 = 7/2 x V C2H5OH = 7/2 x 5 L = 17,5 L
Untuk mencari volume karbon dioksida kita apaka perbandingan alcohol dan CO2.
V C2H5OH : VCO2 = 2 : 4 V CO2 = 4/2 x V C2H5OH = 4/2 x 5 L = 10 L.
