Daftar isi
Setelah mempelajari hukum newton, hukum proust dan hukum kekekalan massa, kali ini kita akan membahas hukum gay lussac.
Tahukah kamu bahwa sebelum pertama kali dikemukakan, Hukum gay lussac pada awal tahun 1781 penemuan yang dikemukakan Joseph Priestley menemukan hidrogen dapat bereaksi dengan oksigen sehingga membentuk air?
Dilanjutkan setelahnya Henry Cavendish menemukan volume hidrogen dan oksigen bereaksi membentuk uap air mempunyai perbandingan konstan 2 : 1.
William Nicholson bersama Antony Carlise berhasilkan menguraikan air menjadi hidrogen dan oksigen.
Pada akhirnya, Joseph Guy Lussac berhasil menemukan volume uap air dengan perbandingan 2 : 1 : 2.
Pengertian Hukum Gay Lussac
Hukum gay lussac adalah hukum yang menyatakan bahwa perbandingan antara volume gas reaktan dan produk dapat dinyatakan dengan bilangan bulat sederhana.
Hukum ini juga dikenal dengan nama hukum perbandingan volume.
Hukum perbandingan volume ini diperkenalkan pertama kali oleh Joseph Louis Gay Lussac, seorang kimiawan dan fisikawan asal Perancis pada tahun 1802.
Maka dari itu hukum perbandingan volume ini juga disebut Hukum Gay-Lussac.
Bunyi Hukum Gay Lussac
“Pada suhu dan tekanan yang sama, perbandingan volume gas pereaksi dengan volume gas hasil reaksi merupakan bilangan bulat dan sederhana (sama dengan perbandingan koefisien reaksinya)” – Joseph Louis Gay Lussac
Artinya, perbandingan dan hasil reaksi yang timbul menghasilkan nilai yang konstan, namun pada suhu dan tekanan yang sama.
Konsep Hukum Gay Lussac
Pada saat melakukan percobaan, Gay-Lussac mencampurkan gas hidrogen dan gas oksigen ke dalam suatu wadah, kemudian terhadap campuran dilewatkan bunga api listrik agar terjadi reaksi.
Hasil reaksi dan gas hasil reaksi dipisahkan berdasarkan perbedaan titik cair komponen campuran dengan cara mengubah fasa uap menjadi cair.
Dengan demikian, hasil reaksi dan volume gas-gas sisa reaksi dapat dipisahkan, kemudian diukur.
Percobaan tersebut dilakukan berulang kali pada suhu dan tekanan tetap.
Hasil pengukuran menunjukkan bahwa perbandingan volume gas hidrogen dan oksigen yang bereaksi dan uap air produk reaksi selalu 2:1:2
[2 volume gas H2 + 1 volume gas O2 → 2 volume uap air
Rumus Hukum Gay Lussac
| Percobaan | Volume gas oksigen yang direaksikan | Volume gas hidrogen yang direaksikan | Volume uap air yang dihasilkan |
| 1 | 1 | 2 | 2 |
| 2 | 2 | 4 | 4 |
| 3 | 3 | 6 | 6 |
Gay Lussac mengemukakan bahwa tekanan dari sejumlah tetap gas pada volume yang tetap berbanding lurus dengan temperatur yang dihitung dalam kelvin.
Secara matematis dapat dinyatakan :
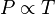
atau
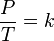
Keterangan :
P = Tekanan gas
T = Temperatur gas (dalam Kelvin)
K = sebuah konstanta
Perlu menjadi catatan penting bahwa hukum perbandingan volume tidak berlaku pada reaksi yang melibatkan zat dalam fase padat dan cair.
Pada zat padat dan cair, koefisien reaksi hanya menyatakan perbandingan mol, tidak menyatakan perbandingan volume.
Contoh Soal dan Pembahasan
Soal 1
Setiap 2 liter gas nitrogen tepat habis bereaksi dengan 3 liter gas oksigen menghasilkan 1 liter gas oksida nitrogen. Jika volume diukur pada suhu dan tekanan yang sama, tentukan rumus molekul oksida nitrogen tersebut.
Jawaban :
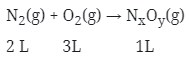
Menurut hukum Gay-Lussac : perbandingan volume = perbandingan koefisien, sehingga perbandingan koefisiennya
2 : 3 : 1 masukan koefisiennya ke reaksi
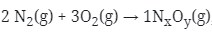
lalu setarakan
Jumlah atom N 4 = x
Jumlah atom O 6 = y
Sehingga rumus molekulnya : N4O6 = N2O3
(sesudah disederhanakan dan disesuaikan dengan senyawa yang stabil)
Soal 2
Berapa liter gas oksigen yang diperlukan untuk membakar 5 liter gas butana (C4H10) agar semua gas butana tersebut habis bereaksi?
Jawaban : Reaksi yang terjadi adalah

Setarakan reaksi :
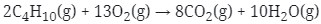
Menurut hukum Gay-Lussac : perbandingan volume = perbandingan koefisien
Untuk mencari volume gas oksigen diperoleh melalui perbandingan koefisien dengan gas butana.
Koefisien C4H10 : koefisien O2 = volume C4H10 : volume O2
2 : 13 = 5 : volume O2
Maka volume O2 = 13/2 x 5 liter = 32,5 Liter.
