Daftar isi
Termodinamika berlaku untuk berbagai topik dalam sains dan teknik, terutama kimia fisik, teknik kimia, dan teknik mesin, tetapi juga dalam bidang yang kompleks seperti meteorologi.
Lalu apa yang dimaksud dengan termodinamika? Berikut pembahasannya.
Pengertian Termodinamika
Termodinamika merupakan cabang fisika yang berhubungan dengan panas dan suhu, dan hubungannya dengan energi, kerja, radiasi, dan sifat-sifat materi.
Perilaku kuantitas ini diatur oleh empat hukum termodinamika yang menyampaikan deskripsi kuantitatif menggunakan kuantitas fisik makroskopik yang terukur, tetapi dapat dijelaskan dalam hal konstituen mikroskopis oleh mekanika statistik.
Sejarah Penemuan Termodinamika

Secara historis, termodinamika berkembang dari keinginan untuk meningkatkan efisiensi mesin uap awal, terutama melalui karya fisikawan Perancis Nicolas Léonard Sadi Carnot (1824) yang percaya bahwa efisiensi mesin adalah kunci yang dapat membantu Prancis memenangkan Perang Napoleon.

Fisikawan Skotlandia, Irlandia Lord Kelvin adalah orang pertama yang merumuskan definisi termodinamika yang singkat pada 1854 yang menyatakan, “Dinamika termo adalah subjek hubungan panas dengan gaya yang bekerja di antara bagian tubuh yang berdekatan, dan hubungan panas. ke agen listrik. “
Hukum Termodinamika
Hukum Awal
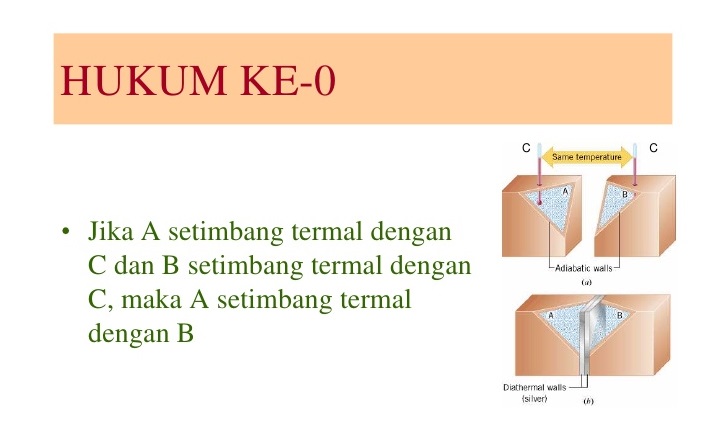
Yaitu Jika dua sistem berada dalam kesetimbangan termal dengan sistem ketiga, maka mereka berada dalam kesetimbangan termal satu sama lain.
Hukum ke-1 Termodinamika
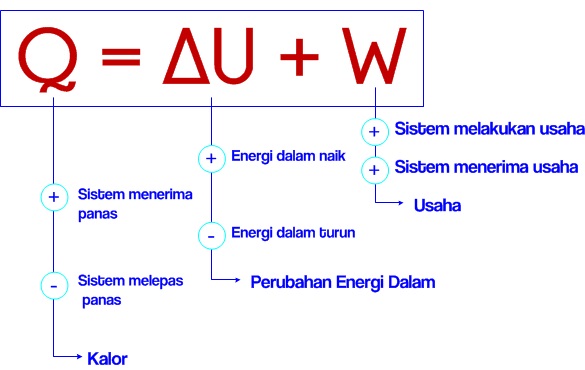
Yaitu Energi tidak dapat diciptakan atau pun dimusnahkan, melainkan hanya bisa diubah bentuknya saja.
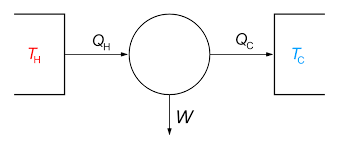
Hukum ke-2 Termodinamika
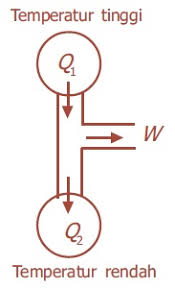
Yaitu Kalor mengalir secara spontan dari benda bersuhu tinggi ke benda bersuhu rendah dan tidak mengalir secara spontan dalam arah kebalikannya.
Hukum ke-3 Termodinamika
Yaitu Suatu sistem yang mencapai temperatur nol absolut, semua prosesnya akan berhenti dan entropi sistem akan mendekati nilai minimum.”Entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol.”
Prinsip termodinamika merupakan hal biasa yang secara alami terjadi dalam kehidupan sehari-hari.
Dengan berkembangnya ilmu pengetahuan dan teknologi, termodinamika direkayasa sedemikian rupa sehingga membentuk mekanisme yang membantu kegiatan manusia.
Sistem Termodinamika
Berikut dijelaskan beberapa sistem didalam Termodinamika:
1. Sistem Terbuka Termodinamika
Sistem terbuka merupakan sistem yang mengakibatkan terjadinya pertukaran energi dan benda dengan lingkungannya.
Sistem terbuka ini meliputi peralatan yang melibatkan adanya aliran massa ke dalam atau ke luar sistem.
Contoh:
- Sistem mesin motor bakar
- Turbin gas dan uap
- Pesawat jet.
2. Sistem Tertutup Termodinamika
Sistem tertutup merupakan sistem yang mengakibatkan terjadinya pertukaran energi tetapi tidak terjadi pertukaran zat dengan lingkungan.
Sistem tertutup terdiri atas suatu jumlah massa yang tertentu dimana massa ini tidak dapat melintasi lapis batas sistem.
Tetapi, energi baik dalam bentuk panas maupun usaha dapat melintasi lapis batas sistem tersebut.
Dalam sistem tertutup, meskipun massa tidak dapat berubah selama proses berlangsung, namun volume dapat saja berubah disebabkan adanya lapis batas yang dapat bergerak pada salah satu bagian dari lapis batas sistem tersebut.
Contoh: Green House yang didalamnya terjadi pertukaran kalor tetapi tidak terjadi pertukaran dengan lingkungan dan Balon udara yang dipanaskan, dimana masa udara didalam balon tetap, tetapi volumenya berubah, dan energi panas masuk kedalam masa udara didalam balon.
3. Sistem Terisolasi Termodinamika
Sistem yang mengakibatkan tidak terjadinya pertukaran panas, zat atau kerja dengan lingkungannya.
Dalam kenyataan, sebuah sistem tidak dapat terisolasi sepenuhnya dari lingkungan, karena pasti ada terjadi sedikit pencampuran, meskipun hanya penerimaan sedikit penarikan gravitasi.
Dalam analisis sistem terisolasi, energi yang masuk ke sistem sama dengan energi yang keluar dari sistem. Contoh : tabung gas.
Proses Termodinamika
Proses yang terjadi pada Termodinamika :
1. Isobarik
Proses termodinamika dimana sistem dijaga agar tekanan konstan. Disini usaha dihasilkan dari perkalian antara tekanan dengan perubahan volume.
Kalor yang masuk ke sistem akan digunakan untuk menambahkan energi dalam dan melakukan usaha sesuai dengan Hukum Termodinamika pertama.
W = p × ΔV atau W = p (V2 – V1)
W : usaha (J)
P : tekanan tetap (N/m2)
V1 : volume awal (m3)
V2 : volume akhir (m3).
2. Isokhorik
Proses termodinamika dimana sistem dijaga agar volume konstan. Sistem ini tidak menghasilkan energi karena nilai perubahan volume 0, sehingga keseluruhan kalor yang masuk digunakan untuk meningkatkan energi dalam sistem.
Oleh karena itu, usaha yang dilakukan gas pada proses isokorik adalah nol
(W = p x 0 = 0 ).
3. Isotermik
Proses termodinamika dimana sistem dijaga agar suhu konstan. Sistem tidak mengalami perubahan energi dalam sehingga seluruh kalor yang masuk akan dikonversi menjadi usaha.
Dikarenakan tekanannya tidak konstan. Namun, dapat diselesaikan dengan melakukan pengintegralan sebagai berikut.
Ingat, maka
karena n, R, dan T konstan, maka persamaannya menjadi sebagai berikut:
4. Adiabatik
Proses termodinamika dimana sistem diisolasi agar tidak ada kalor yang masuk maupun keluar.
Proses terjadinya biasanya sangat cepat. Sistem tidak menerima maupun mengeluarkan kalor sehingga usaha yang dilakukan berasal dari pengurangan energi dalam sistem.
Dengan γ merupakan perbandingan kalor jenis gas pada tekanan tetap (Cp) dan kalor jenis gas pada volum tetap (CV).
Selanjutnya, perbandingan ini dinamakan tetapan Laplace.
Untuk gas ideal,
sehingga persamaan adiabatik di atas dapat ditulis dalam bentuk :
Adapun usaha pada proses adiabatik dapat dicari dengan cara sebagai berikut.
Karena p = CV-γ , maka
karena C = p1 V1γ = p2 V2γ , maka
Pada bagian sebelumnya kita telah membahas mengenai energi dalam gas monoatamik. kita juga mengetahui bahwa , maka :
Oleh karena itu, usaha yang dilakukan oleh sistem pada proses adiabatik dapat juga dituliskan :
Contoh soal dan Pembahasan
Soal 1
Suatu gas memiliki volume awal 2,0 m3 dipanaskan dengan kondisi isobaris hingga volume akhirnya menjadi 4,5 m3. Jika tekanan gas adalah 2 atm, tentukan usaha luar gas tersebut!
(1 atm = 1,01 x 105 Pa)
Jawaban :
W = P (ΔV) W = P(V2 − V1) W = 2,02 x 105 (4,5 − 2,0) = 5,05 x 105 joule.
Soal 2
Volume awal dari suatu gas adalah 3 m3 akan dipanaskan secara isobarik agar volume nya berubah menjadi 6 m3. Jika diketahui tekanan gas adalah 2 atm, berpakah usaha luar gas tersebut!
(1 atm = 1,01 x 105 Pa)
Jawaban:
Isobaris → Tekanan Tetap
W = P (ΔV)
W = P(V2 − V1)
W = 2,02 × 105 × (6 − 3)
W = 2,02 × 105 × 3
W = 6,06 × 105 Joule
Jadi, usaha luar gas tersebut adalah 6,06 × 105 Joule.
