Daftar isi
Asam adalah zat yang dalam air dapat menghasilkan ion hidrogen (H+) atau senyawa yang menyebabkan rasa masam pada berbagai materi, misalnya cuka, keju, dan buah-buahan. Sifat khas lain dari asam adalah dapat bereaksi dengan berbagai bahan seperti logam, marmer, dan keramik.
Basa adalah zat yang dalam air dapat menghasilkan ion hidroksida (OH–). Oleh karena itu, semua rumus kimia basa umumnya mengandung gugus OH. Dalam keadaan murni, basa umumnya berupa kristal padat dan bersifat kaustik.
Teori Asam dan basa
Asam dan basa memiliki beberapa teori, diantaranya :
Teori Arrhenius
Teori Arrhenius dalam asam adalah zat yang dapat melepaskan ion H+ jika dilarutkan dalam air.
Contoh :
HCl -> H+ + Cl–
H2SO4 -> 2H+ + SO42-
Basa adalah zat yang melepaskan ion OH– jika dilarutkan dalam air.
Contoh :
NaOH -> Na+ + OH–
Ba(OH)2 -> Ba2++ 2OH–
Teori Bronsted Lowry
Teori asam basa menurut Arrhenius mempunyai beberapa keterbatasan, salah satu diantaranya adalah membahas gejala asam basa hanya dalam pelarut air, padahal banyak reaksi-reaksi yang dilakukan dalam pelarut bukan air. Oleh karena itu kemudian disempurnakan oleh Bronsted Lowry dengan melihat dari sisi proton (H+).
Asam zat yang memberikan H+ (donor proton), sedangkan basa zat yang menerima H+(akseptor proton). Pada teori asam basa bronsted lowry ada istilah pasangan asam basa konjugasi.
Contoh :
HA + H2O -> H3O+ + A–
Disini dapat di uraikan HA basa, H2O basa, H3O+ asam, A– konjugasi
Amfiprotik/amfoter dapat bersifat asam/basa. Contoh : H2O, NH3, COO, H2PO4–
Teori Lewis
Teori lewis ini melihat dari sisi elektron (pasangan elektron bebas atau PEB). Asam zat yang meneriman PEB, Contoh H+, kation logam (Fe3+, Al3+, B3+)
Senyawa melibatkan unsur golongan IIIA biasanya asam lewis kuat (membentuk ikatan kovalen koordinasi). Basa zat yang memberi PEB, contoh : OH– atom dan ion dari golongan VA – VIIA, contoh reaksi asam basa lewis pada senyawa NH3BF3.
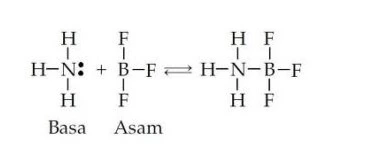
Kekuatan asam dan basa
Kekuatan asam dan basa ditentukan dengan derajat ionisasi (α)-nya dengan banyak dan sedikitnya ion H+ dan OH− yang telah dilepaskan. Asam dan basa yang ada di dalam air kemudian menjadi reaksi dengan penguraian sehingga menjadi ion yang disebut dengan reaksi kesetimbangan.
Kekuatan asam dan basa ditetapkan oleh kesetimbangan ionisasi asam (Ka) dan tetapan ionisasi basa (Kb). Kekuatan asam dan basa dibedakan menjadi 3, yaitu :
Asam kuat dan basa kuat
Senyawa-senyawa yang termasuk didalam asam atau basa kuat adalah yang sebagian besar atau seluruhnya terurai (terionisasi) menjadi ion-ionnya.
| Asam kuat | Basa kuat |
| HCl ( asam klorida) | NaOH (natrium hidroksida) |
| Hl (asam iodida) | KOH (kalium hidroksida) |
| HBr (asma bromida) | Ba(OH)2 (barium hidroksida) |
| HNO3 (asam nitrat) | Ca(OH)2 (kalsium hidroksida) |
| H2SO4 (asam sulfat) | Sr(OH)2 (stronsium hidroksida) |
Asam lemah dan basa lemah
Senyawa-senyawa yang termasuk didalam asam atau basa lemah adalah jika hanya sebagian saja yang terurai (terionisasi) menjadi ion-ionnya.
| Asam lemah | Basa lemah |
| HF (asam fluorida) | NH3 (amonia) |
| CH3COOH (asam asetat) | Al(OH)3 (aluminium hiroksida) |
| H2S (asam sulfida) | NH2OH (hidroksil amnksida) |
| H3PO4 (asam fosfat) | Fe(OH)3 (kalsium hidroksida) |
| H2C2O4 (asam oksidat) |
Karena asam lemah hanya sebagian kecil saja yang terionisasi, maka terjadi kesetimbangan reaksi antara ion yang dihasilkan asam/basa tersebut dengan molekul senyawanya. Semakin besar nilai tetapan ionisasi asamnya, maka semakin banyak ion H+ yang dihaasilkan, dan semakin kuat asam tersebut. Begitu pula pada senyawa basa.
Derajat disosiasi
Banyak sedikitnya jumlah zat yang terionisasi dinyatakan dengan derajat disosiasi. Semakin besar derajat disosiasinya, makan semakin kuat asam/basa tersebut.
α = jumlah zat yang terionisasi (terurai) : jumlah zat mula-mual
Indikator asam basa
Larutan asam dan basa dapat diidentifikasi melalui ukuran derajat keasamannya. Asam memiliki pH < 7, sedangkan basa memiliki pH > 7. Dalam mengenali sifat asam atau basa suatu larutan, kita dapat menggunakan indikator asam basa, yaitu bahan kimia yang dapat menunjukkan warna berbeda dalam larutan asam dan basa.
Contohnya adalah kertas lakmus. Kertas akan berwarna biru dalam larutan basa, sedangkan lakmus merah akan berwarna merah dalam larutan asam. Selain itu, indikator asam basa juga dapat untuk menentukan pH.
Nilai pH dapat diukur dengan :
- pH meter
- Trayek perubahan warna indikator asam basa merupakan batas-batas pH ketika indikator mengalami perubahan warna. Setiap indikator mempunyai trayek perubahan warna tertentu untuk nilai-nilai pH tertentu.
- Bila pH < trayek pH, maka indikator akan menunjukkan warna asamnya.
- Bila pH > trayek pH, maka indikator akan menunjukkan warna basa.
Tabel trayek perubahan warna beberapa indikator
| Indikator | perubahan warna | trayek pH |
| Metil jingga | merah – kuning | 3,1-4,4 |
| Metil merah | merah – kuning | 4,2-6,2 |
| Lakmus | merah – biru | 6,0-7,6 |
| Fenolftalein | tak berwarna-merah muda | 8,0-9,6 |
Reaksi asam basa
Reaksi asam basa adalah terlepasnya ion hidrogen dari asam yang di tambahkan ke basa. Pelepasan antara ion hidrogen asam yang akan menghasilakn basa konjugasi, merupakan asam dengan ion hidrogen yang sudah terlepas.
Terdapat reaksi asam basa, yaitu :
Reaksi Netralisasi
Asam + basa -> garam + air
M1.V1. a = M2.V2.b
M1 = konsentrasi zat 1
M2 = konsentrasi zat 2
V1 = volume zat 1
V2 = volume zat 2
a = valensi asam (jumlah H+)
b = valensi basa (jumlah OH–)
Reaksi pengenceran
Asam + air atau basa + air
M1. V1 = M2. V2
Campuran sesama larutan asam/basa
- Campuran sesama larutan asam
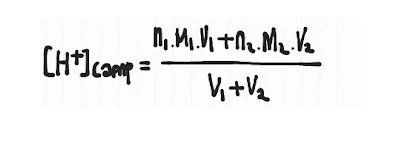
- Campuran sesama larutan basa
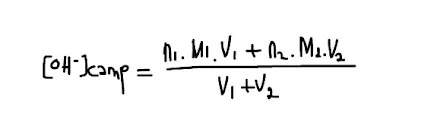
pH larutan asam basa
pH sebagai minus logaritma konsentrasi ion hidrogen. Berikut rumus menurut kekuatannya.
- Rumus asam/ basa kuat
[H+] = Ma. valensi asam
[OH–] = Mb. valensi basa
H2SO4 -> 2H+ + SO42- menjadi valensi asamnya adalah 2
pH = – log [H+]
POH = – log [OH–]
pH = pkw – pOH = 14 – pOH
- Rumus asam/ basa lemah
Keterangan :
Ka = tetapan kesetimbangan asam
kb = tetapan kesetimbangan basa
Ma = konsentrasi asam
Mb = konsentrasi basa
α = derajat disosiasi
