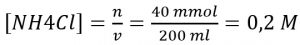Pada pembahasan kali ini kita akan menyinggung tentang materi hidrolisis. Salah satu contoh proses hidrolisis adalah pembentukan garam.
Penjelasan lebih lanjut terkait pengertian, macam-macam hidrolisis, macam macam garam hasil hidrolisis dan sekaligus contoh serta pembahasannya ada di bawah ini.
Pengertian Hidrolisis
Hidrolisis diartikan sebagai suatu reaksi yang melibatkan molekul H2O untuk terurai membentuk kation H+ dan anion OH-.
Hidrolisis berasal dari Bahasa Yunani yaitu hydro yang berarti air dan lysis yang artinya pemisahan.
Umumnya hidrolisis dilakukan untuk memecah polimer yang membutuhkan beberapa tahap dalam pemisahan.
Beberapa contoh hidrolisis adaalah proses sakarifikasi sukrosa, yaitu pemecahan sukrosa menjadi fruktosa dan galaktosa.
Adapula istilah lain dalam proses hidrolisis yaitu kondensasi. Kondensasi adalah suatu reaksi yang berkebalikan dengan hidrolisis yaitu, proses penggabungan dua molekul dengan mengeluarkan air ketika proses sedang berlangsung.
Jadi dapat disimpulkan bahwa perbedaan kondensasi terletak pada penggunaan air dalam pembentukan molekul.
Jika hidrolisis menambahkan air dalam pembentukan, sedangkan kondensasi membuang air ketika proses berlangsung.
Macam-macam Hidrolisis
Hidrolisis dibedakan menjadi dua macam yaitu:
- Hidrolisis parsial atau sebagian
Hidrolisis ini dapat terjadi karena jika garam berasal dari asam lemah atau basa kuat.
Sedangkan hidrolisis sebagian terbentuk karena adanya salah satu ion saja yang mengalami hidrolisis.
Sebagai contoh adalah garam NH4Cl yang terionisasi sempurna menjadi Cl- dan NH4+.
- Hidrolisis Total
Hidrolisis total adalah hidrolisis yang terjadi apabila garam berasal dari asam lemah dan basa lemah sehingga terjadi ionisasi sempurna dalam air.
Pada hidrolisis ini baik kation atau anion mengalami hidrolisis total karena keduanya merupakan spesies lemah. Contohnya adalah hydrogen fluorida.
Macam-macam Garam
Jika berdasarkan penyusunnya, maka garam terbagi menjadi
- Garam dari Larutan Asam Kuat dengan Basa Kuat
Salah satu contoh garam tersebut yaitu natrium klorida. Pada reaksi ini, NaCl menghasilkan ion Na+ dari basa kuat dan ion Cl- dari asam kuat.
Dikarenakan garam NaCl bersifat netral, maka pH larutan pun berada di antara 7,0. Persamaan reaksi dari pembuatan garam NaCl yaitu:
NaOH + HCl --> NaCl + H2O
- Garam dari Larutan Asam Kuat dan Basa Lemah
Salah satu contoh dari garam yang terbentuk dari asam kuat dan basa lemah adalah aluminium klorida.
AlCl3 menghasilkan ion Al3+ dari basa lemah dan ion Cl- dari asam kuat. Dikarenakan terbentuk dari asam kuat, maka AlCl3 bersifat asam. Reaksi pembuatannya adalah
Al(OH)3 + 3HCl --> AlCl3 + 3H2O
- Garam dari Larutan Basa Kuat dan Asam Lemah
Salah satu contoh adalah Na2C2O4. Reaksi ionisasi natrium oksalat tersebut menghasilkan ion Na+ dari basa kuat dan ion C2O42- dari asam lemah.
Garam ini terbentuk dari basa kuat sehingga bersifat basa. Persamaa reaksi dari garam tersebut adalah
2NaOH + H2C2O4 --> Na2C2O4 + 2H2O.
- Garam dari Larutan Basa Lemah dan Asam Lemah
Salah satu contoh garam yang terbentuk adalah ammonium sianida. Pada reaksi ionisasi, NH4CN menghasilkan ion NH4+ yang berasal dari basa lemah dan CN- yang berasal dari asam lemah. Reaksi pembentukan garamnya adalah sebagai berikut.
NH4OH + HCN --> NH4CN + H2O
- Garam dari Unsur Logam dan Unsur Non Logam
Salah satu contoh garam yang terbentuk adalah MgO. Berikut persamaan reaksinya
Mg + O2 --> 2MgO
Contoh Soal dan Pembahasan
1. Garam CH2COONa sebanyak 410 mg dilarutkan ke dalam air sehingga volumenya menjadi 500 ml. jika diketahui tetapan hidrolisis Kb = 10^2 maka tentukan pH larutan garam tersebut.
Jawab:
Diketahui CH2COONa sebanyak 410 mg merupaakan garam yang terbentuk dari basa kuat dan asam lemah. Sehingga garam yang dihasilkan bersifat basa.
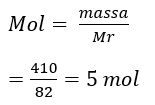
Konsentrasi garam dihitung dengan
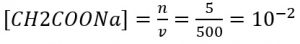
Karena bersifat basa, maka
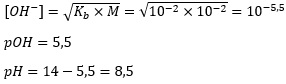
2. Jika 100 ml NH4OH 0,4 M bereaksi dengan 100 ml HCl 0,4 M dengan Kb = 2 x 10^-6 maka hitung pH campuran setelah reaksi