Daftar isi
Dalam kehidupan kita, banyak reaksi kimia yang sering terjadi. Baik itu reaksi sederhana maupun reaksi kimia yang kompleks. Salah satu reaksi sederhana yang sering terjadi adalah hidrolisis. Hidrolisis merupakan suatu reaksi yang melibatkan molekul air untuk pemecahan senyawa.
Hidrolisis banyak digunakan di bidang industri untuk memecahkan struktur kimia tertentu supaya mendapatkan bagian yang lebih sederhana. Oleh karena itu, terdapat banyak proses kimia yang terjadi dari reaksi hidrolisis.
Supaya lebih jelas lagi tentang hidrolisis, di bawah ini merupakan penjelasan lengkapnya:
Pengertian Hidrolisis
Hidrolisis merupakan gabungan dua kata yang berasal dari bahasa Yunani Kuno. Yakni terdiri dari kata Hydro yang artinya “air”, dan Lisis yang bermakna “tidak mengikat”.
Pengertian hidrolisis menurut Biology LibreTexts adalah reaksi yang menghasilkan pemecahan polimer menjadi monomer menggunakan molekul air serta katalis enzimatik. Pada hidrolisis, air berfungsi untuk memecahkan polimer menjadi monomer, merupakan kebalikan dari proses sintesis dehidrasi. Sebab pada proses sintesis dehidrasi justru membentuk air ketika melakukan sintesis polimer dan monomer.
Sedangkan menurut Encyclopedia Britanica, hidrolisis dalam kimia dan fisiologi, merupakan dekomposisi ganda dengan air yang digunakan sebagai salah satu reaktan.
Teori Hidrolisis
Istilah hidrolisis secara luas dipergunakan untuk reaksi substitusi, eliminasi dan solvasi yang mana air merupakan nukleofil. Proses setiap reaksi kimia pada hidrolisis, molekul air akan memecah satu atau lebih ikatan kimia. Pada hidrolisis yang merupakan jenis reaksi dekomposisi, air digunakan sebagai media pemecah ikatan zat atau ikatan kimia pada suatu zat.
Hidrolisis ini kebalikan dari reaksi sintesis kondensasi. Sebab reaksi sintesis kondensasi merupakan proses saling bergabungnya dua molekul untuk membentuk molekul yang lebih kompleks dengan melakukan pelepasan air. Cara mudah mengetahui perbedaan keduanya yaitu reaksi hidrolisis memerlukan air, sementara reaksi kondensasi justru menghasilkan air. Air atau H2O mengalami fragmentasi dan menjadi ion H+ (hidrogen) dan ion OH- (hidroksida). Ion inilah yang berperan dalam reaksi hidrolisis.
Jenis Reaksi Hidrolisis
Berlangsungnya reaksi hidrolisis terjadi dengan adanya beberapa bahan kimia awal juga reaktan. Berdasarkan reaktan awalnya, hidrolisis terbagi menjadi banyak jenis. Namun dalam artikel ini hanya akan dijelaskan reaksi hidrolisis garam.
Terdapat dua jenis reaksi hidrolisis garam, yaitu:
- Reaksi Hidrolisis Garam Sempurna/Total
Pertama jenis reaksi sempurna/total, yaitu reaksi hidrolisis yang terjadi dimana garam dihasilkan dari reaksi asam lemah dan basa lemah saat dilarutkan dalam air.
Sifat garam pada Hidrolisis sempurna bergantung pada nilai Ka dan Kb. Cara menentukannya sebagai berikut:
- Jika Ka = Kb, maka garam tersebut bersifat netral
- Jika Ka > Kb, maka garam tersebut bersifat asam
- Jika Kb > Ka, maka garam tersebut bersifat basa
- Reaksi Hidrolisis Sebagian/Parsial
Jenis hidrolisis garam yang kedua yaitu reaksi hidrolisis sebagian atau parsial. Jenis terbagi menjadi dua, sebagai berikut:
- Reaksi Garam Parsial Asam Lemah-Basa Kuat
Reaksi hidrolisis garam yang terjadi karena garam terbentuk dari reaksi asam lemah dan basa kuat dilarutkan dalam air. Hal ini menyebabkan kation dari basa tidak dapat terhidrolisis, sementara anion asam kuat akan mengalami proses hidrolisis.
- Reaksi Garam Parsial Asam Kuat-Basa Lemah
Reaksi hidrolisis jenis ini terjadi apabila garam dihasilkan dari reaksi yang terjadi antara asam kuat dan basa lemah yang dilarutkan dalam air. Seperti yang terjadi saat garam amonium klorida (NH4CL) terbentuk dari reaksi antara basa lemah amonia dengan asam kuat HCL.
Larutan tersebut mengandung ion amonium (NH4+) dan ion klorida (CL–). Ion klorida tidak berpengaruh terhadap keasaman larutan walaupun HCL adalah asam kuat. Sementara ion amonium merupakan asam konjugasi dari amonia yang bereaksi dengan air yang kemudian membentuk ion hidronium (H3O+) yang memberikan keasaman pada larutan.
Cara Menghitung Nilai pH
Cara menghitung nilai pH dari garam-garam tersebut ialah seperti berikut ini:

Apabila garamnya berasal dari kation atau anion yang salah satunya bervalensi dua, maka cara menghitung pHnya adalah:

Nilai Garam dari basa kuat dan asam lemah yaitu pH > 7. Maka garam ini bersifat basa.
Nilai Konsentrasi [OH–] adalah:

Sedangkan untuk hasil hidrolisis garam yang terbentuk dari asam lemah dan basa lemah, maka sifat garamnya bergantung pada nilai ketetapann masing-masing. Nilai ketetapan tersebut dapat dihitung dengan cara sebagai berikut:
Jika Ka = Kb
Maka garam tersebut bersifat netral atau pH = 7.
Sedangkan Jika Ka > Kb
Maka garam tersebut bersifat asam atau pH < 7.
Maka nilai H+ dapat dihitung seperti ini:
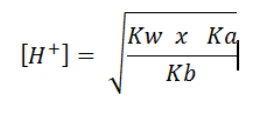
Jika nilai Kb > Ka
Maka nilai garam tersebut adalah pH > 7 dan sifat garamnya bersifat basa.
Nilai [OH–] =
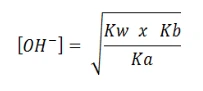
Contoh Soal Hidrolisis
Berikut ini contoh soal dari pembahasan hidrolisis:
Diketahui Garam CH3COONa (Mr = 82) sebanyak 410 mg dilarutkan dalam air hingga volume 500 mL. Jika tetapan hidrolisisnya (Kb = 10-2), tentukan pH larutan garam tersebut.
Jawab:
Berdasarkan dari senyawa yang bergabung pada larutan tersebut adalah basa kuat dan asam lemah, maka garam yang dihasilkan bersifat basa. Jadi proses perhitungannya adalah sebagai berikut:

Jadi, berdasarkan perhitungan nilai pH nya 8,5 dan larutan garam tersebut bersifat basa.
Manfaat Hidrolisis Garam dalam Kehidupan
Banyak manfaat dari proses hidrolisis garam dalam kehidupan sehari-hari, di antaranya:
- Garam amonium nitrat (NH4NO3) yang biasa digunakan sebagai alat kompres dingin, merupakan campuran dari basa lemah dan asam kuat. Sehingga garam ini bersifat asam.
- Monosodium Glutamat atau MSG (C5H8NO4Na) digunakan sebagai penyedap rasa makanan, merupakan campuran dari asam lemah dan basa kuat. Maka garam ini bersifat basa.
- Kalium nitrat biasanya digunakan untuk pengawet pada sosis KNO3 yang terbentuk dari senyawa asam lemah dan basa lemah.
