Daftar isi
Elektrokimia merupakan ilmu yang mempelajari hubungan antara perubahan (reaksi) kimia dengan kerja listrik, biasanya melibatkan sel elektrokimia yang menerapkan prinsip reaksi redoks dalam aplikasinya.
Dalam sel elektrokimia dibagi menjad 2, yaitu :
Sel volta (sel Galvani)
Potensial sel (Eosel) dan notasi sel (diagram sel)
Potensial sel volta dapat dihitung berdasarkan data potensial elektrode positif (katode) dan potensial elektrode negatif (anode).
Eosel = Eokatode – Eokatode
Eosel = Eoreduksi – Eooksidasi
- Katode adalah elektrode yang memiliki Eo lebih besar (lebih positif)
- Anode adalah elektrode yang memiliki Eo lebih kecil (lebih negatif)
Penulisan notasi sel
- Anoda II katoda
- Oksidasi II reduksi
- Padatan di anoda I ion II ion II padatan di katoda
Deret volta
Deret volta adalah urutan logam-logam berdasarkan kenaikan Eo, yaitu dari Eo kecil ke Eo besar. Logam yang letaknya di kiri pda deret volta dapat mendesak ion logam yang berada di kanannya dalam deret volta.
Elektrolisis
Pada sel elektrolisis merupakan kebalikan dari sel volta. Katode yang menjadi tempat reduksi bermuatan negatif, sedangkan anode yang menjadi tempat oksidasi bermuatan positif. Karena katoda kutub negatif, maka yang menuju katode adalah ion-ion bermuatan positif.
Sedangkan yang menuju anoda adalah ion-ion bermuatan negatif. Pada anoda kita harus memperhatikan elektrodenya inert atau tidak inert.
- Reaksi-reaksi di katode dan anode
Reaksi reduksi air (H2O) : 2H2O(I) +2 e → H2(g) + 2OH–(aq)
Reaksi oksidasi air (H2O) : 2H2O(I) → 4H+(aq) + O2(g) + 4e
- Hukum faraday
Hubungan kuantitatif antara massa zat yang dibebaskan pada elektrolisis dengan jumlah listrik yang dignakan disimpulkan dalam hukum Faraday.
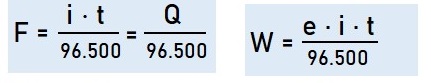
W = massa zat yang dibebaskan (garam)
e = berat ekivalen = Ar/valensi logam
F = jumlah listrik (faraday)
1 mol elektron = 1 faraday = 96500 Coloumb
i = kuat arus (ampere)
t = waktu elektrolisis (detik)
Jika diketahui 2 buah larutan atau lebih dialiri muatan listrik dengan jumlah yang sama, maka yang diproleh persamaan :
w1/w2 = e1/e2
