Daftar isi
Berikut pembahasan mengenai Sel Elektrolisis.
Pengertian Sel Elektrolisis
Sel elektrolisis adalah contoh lain dari sel elektrokimia. Namun, ia bekerja dengan cara yang berlawanan dengan sel volta. Alih-alih menghasilkan listrik melalui reaksi kimia, sel elektrolitik mendorong reaksi kimia yang berguna dengan bantuan perbedaan potensial yang diterapkan secara eksternal.
Sel elektrolisis mengubah energi listrik menjadi energi potensial kimia. Prosesnya dikenal sebagai elektrolisis. Tujuannya biasanya untuk mengubah reaktan menjadi produk yang lebih berguna.
Ciri-ciri Sel Elektrolisis
Adapun ciri-ciri dari Sel elektrolisis adalah mempunyai 3 komponen utama. Tiga komponen utama sel elektrolisis adalah:
- Katoda (yang bermuatan negatif untuk sel elektrolitik)
- Anoda (yang bermuatan positif untuk sel elektrolitik)
- Elektrolit.
Elektrolit menyediakan media untuk pertukaran elektron antara katoda dan anoda. Elektrolit yang umum digunakan dalam sel elektrolitik termasuk air (mengandung ion terlarut) dan natrium klorida cair.
Kegunaan Sel Elektrolisis
- Elektrolisis NaCl dalam Air
Sekali lagi, ion Na + bermigrasi ke arah elektroda negatif dan ion Cl – bermigrasi ke arah elektroda positif. Tapi, sekarang ada dua zat yang bisa direduksi di katoda: ion Na + dan molekul air.
| Katoda (-): | |||
Na + + e –  ” width=”17″ height=”9″> Na ” width=”17″ height=”9″> Na | E o merah = -2,71 V | ||
2 H 2 O + 2 e –  ” width=”17″ height=”9″> H 2 + 2 OH – ” width=”17″ height=”9″> H 2 + 2 OH – | E o merah = -0,83 V |
Karena air lebih mudah direduksi daripada ion Na + , satu-satunya produk yang terbentuk di katoda adalah gas hidrogen.
| Katoda (-): | 2 H 2 O( l ) + 2 e –  ” width=”17″ height=”9″> H 2 ( g ) + 2 OH – ( aq ) ” width=”17″ height=”9″> H 2 ( g ) + 2 OH – ( aq ) |
Ada juga dua zat yang dapat dioksidasi di anoda: ion Cl – dan molekul air.
| Anoda (+): | |||
2 Cl –  ” width=”17″ height=”9″> Cl 2 + 2 e – ” width=”17″ height=”9″> Cl 2 + 2 e – | E o sapi = -1,36 V | ||
2 H 2 O  ” width=”17″ height=”9″>O 2 + 4 H + + 4 e – ” width=”17″ height=”9″>O 2 + 4 H + + 4 e – | E o sapi = -1,23 V |
Potensi standar-negara untuk setengah-reaksi ini sangat dekat satu sama lain bahwa kita mungkin mengharapkan untuk melihat campuran Cl 2 dan O 2 gas mengumpulkan di anoda. Dalam prakteknya, satu-satunya produk dari reaksi ini adalah Cl 2 .
| Anoda (+): | 2 Cl –  ” width=”17″ height=”9″> Cl 2 + 2 e – ” width=”17″ height=”9″> Cl 2 + 2 e – |
Sepintas, akan tampak lebih mudah mengoksidasi air ( E o ox = -1,23 volt) daripada ion Cl – ( E o ox = -1,36 volt). Perlu dicatat, bagaimanapun, bahwa sel tidak pernah diizinkan untuk mencapai kondisi keadaan standar. Solusinya biasanya 25% NaCl massa, yang secara signifikan mengurangi potensi yang diperlukan untuk mengoksidasi ion Cl – . PH sel juga dijaga sangat tinggi, yang menurunkan potensi oksidasi air. Faktor penentu adalah fenomena yang dikenal sebagai tegangan lebih , yang merupakan tegangan ekstra yang harus diterapkan pada suatu reaksi untuk membuatnya terjadi pada tingkat yang akan terjadi dalam sistem yang ideal.
Dalam kondisi ideal, potensi 1,23 volt cukup besar untuk air mengoksidasi ke O 2 gas. Dalam kondisi nyata, bagaimanapun, dibutuhkan tegangan yang jauh lebih besar untuk memulai reaksi ini. (Tegangan lebih untuk oksidasi air dapat mencapai 1 volt.) Dengan memilih elektroda secara hati-hati untuk memaksimalkan tegangan lebih untuk oksidasi air dan kemudian dengan hati-hati mengontrol potensi di mana sel beroperasi, kita dapat memastikan bahwa hanya klorin yang dihasilkan dalam reaksi ini.
Singkatnya, elektrolisis larutan natrium klorida dalam air tidak menghasilkan produk yang sama seperti elektrolisis natrium klorida cair. Elektrolisis lelehan NaCl menguraikan senyawa ini menjadi unsur-unsurnya.
| elektrolisa | ||
| 2 NaCl( l ) |  ” width=”17″ height=”9″> ” width=”17″ height=”9″> | 2 Na( l ) + Cl 2 ( g ) |
Elektrolisis larutan NaCl berair menghasilkan campuran hidrogen dan gas klorin dan larutan natrium hidroksida berair.
| elektrolisa | ||
| 2 NaCl( aq ) + 2 H 2 O( l ) |  ” width=”17″ height=”9″> ” width=”17″ height=”9″> | 2 Na + ( aq ) + 2 OH – ( aq ) + H 2 ( g ) + Cl 2 ( g ) |
Karena permintaan klorin jauh lebih besar daripada permintaan natrium, elektrolisis natrium klorida berair adalah proses yang lebih penting secara komersial. Elektrolisis larutan NaCl berair memiliki dua keuntungan lain. Ini menghasilkan gas H 2 di katoda, yang dapat dikumpulkan dan dijual. Ini juga menghasilkan NaOH, yang dapat dikeringkan dari bagian bawah sel elektrolitik dan dijual.
Susunan Sel Elektrolisis
Sel ini biasanya terdiri dari dua konduktor logam atau elektronik (elektroda ) diadakan terpisah satu sama lain dan dalam kontak dengan elektrolit ( qv ), biasanya terlarut atau menyatu dalam senyawa ionik.
Sambungan elektroda ke sumber arus listrik searah membuat salah satunya bermuatan negatif dan yang lainnya bermuatan positif. Ion positif dalam elektrolit bermigrasi ke elektroda negatif (katoda) dan di sana bergabung dengan satu atau lebih elektron, kehilangan sebagian atau seluruh muatannya dan menjadi ion baru yang memiliki muatan lebih rendah atau atom atau molekul netral; pada saat yang sama, ion negatif bermigrasi ke elektroda positif (anoda) dan mentransfer satu atau lebih elektron ke dalamnya, juga menjadi ion baru atau partikel netral. Efek keseluruhan dari dua proses adalah transfer elektron dari ion negatif ke ion positif, reaksi kimia.
Prinsip Kerja Sel Elektrolisis
Sel elektrolisis digunakan untuk melakukan elektrolisis. Akhiran -lysis dalam bahasa Yunani berarti berpisah. Istilah elektrolisis, oleh karena itu, adalah proses di mana suatu senyawa dipecah menjadi unsur-unsur penyusunnya dengan bantuan energi listrik.
Dalam sel elektrolisis, senyawa yang akan dipecah diubah menjadi cairan dan digunakan sebagai elektrolit. Dua elektroda inert direndam dalam larutan elektrolit ini, dan secara eksternal, perbedaan potensial dibuat di antara mereka menggunakan sumber ggl. Hal ini menyebabkan satu elektroda menjadi bermuatan positif, sedangkan yang lain menjadi bermuatan negatif.
Karena ggl ini, unsur-unsur elektrolit cair terpecah menjadi ion positif dan negatif, dengan ion bermuatan positif tertarik dan disimpan di elektroda negatif, sedangkan ion negatif disimpan di elektroda bermuatan positif. Dengan demikian, elektrolisis, atau pemisahan senyawa menggunakan energi listrik tercapai. Ini adalah prinsip kerja dasar sel elektrolisis.
Reaksi Sel Elektrolisis
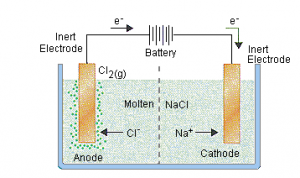
Di sini, dua elektroda inert dicelupkan ke dalam lelehan natrium klorida (yang mengandung kation Na + dan Cl – anion terdisosiasi ). Ketika arus listrik dilewatkan ke dalam rangkaian, katoda menjadi kaya akan elektron dan mengembangkan muatan negatif. Kation natrium yang bermuatan positif sekarang tertarik ke arah katoda yang bermuatan negatif. Ini menghasilkan pembentukan logam natrium di katoda.
Secara bersamaan, atom klorin tertarik ke katoda bermuatan positif. Ini menghasilkan pembentukan gas klorin (Cl 2 ) di anoda (yang disertai dengan pembebasan 2 elektron, menyelesaikan rangkaian). Persamaan kimia terkait dan reaksi sel secara keseluruhan disediakan di bawah ini.
- Reaksi di Katoda: [Na + + e – → Na] x 2
- Reaksi di Anoda: 2Cl – → Cl 2 + 2e –
- Reaksi Sel: 2NaCl → 2Na + Cl 2
Dengan demikian, natrium klorida cair dapat mengalami elektrolisis dalam sel elektrolitik untuk menghasilkan natrium logam dan gas klor sebagai produk.
Contoh Sel Eletrolisis
- Pembuatan Natrium
Elektrolisis digunakan untuk memproduksi logam natrium dari natrium klorida. - Mengisi Ulang Baterai
Elektrolisis digunakan untuk mengisi ulang baterai yang dapat diisi ulang: baterai yang dapat diisi ulang beroperasi sebagai sel volta ketika mereka menyalakan perangkat dan sebagai sel elektrolitik selama pengisian ulang. Misalnya, baterai Edison adalah sel sederhana yang dapat diisi ulang yang ditemukan oleh Thomas Edison. Ini terdiri dari dua elektroda logam , satu terbuat dari besi, yang lain dari nikel. Selama pengisian awal, lapisan oksida nikel terbentuk pada elektroda nikel. (cairan ionik antara elektroda) adalah air kalium hidroksida. Saat dikosongkan, sel Edison beroperasi sebagai sel volta. Ketika sedang diisi, sel beroperasi sebagai sel elektrolitik. Persamaan kimia untuk reaksi di elektroda adalah: Ni 2 O 3 + H 2 O + 2 e – 2 NiO + 2 OH – Fe + 2 OH – Fe(OH) 2 + 2 e – Selama pelepasan, ketika sel memberikan energi listrik, reaksi di atas berlangsung dari kiri ke kanan. Selama pengisian, ketika sel beroperasi secara elektrolitik, mengubah energi listrik menjadi energi potensial kimia, reaksi di atas berlangsung dari kanan ke kiri. - Elektrolisis Air
Elektrolisis air menghasilkan bahan bakar bersih terbaik; salah satu Cawan Suci kimia adalah untuk membagi air menggunakan sinar matahari. Arus searah dapat digunakan untuk memisahkan air, seperti yang ditunjukkan pada diagram Di katoda, ion hidrogen memperoleh elektron: 2H + (aq) + 2e – → H 2 (g) Di anoda, air kehilangan elektron, membentuk ion oksigen dan hidrogen: 2H 2 O (l) → O 2 (g) + 4H + (aq) + 4e
Contoh Soal Sel Elektrolisis
Contoh 1
Hitung volume H 2 gas pada 25 o C dan 1,00 atm yang akan mengumpulkan pada katoda ketika larutan Na 2 SO 4 adalah elektrolisis untuk 2,00 jam dengan arus 10,0-amp.
Jawab :
Kita mulai dengan menghitung jumlah muatan listrik yang melewati larutan.
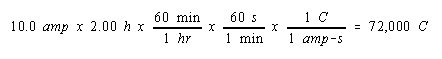
Kami kemudian menghitung jumlah mol elektron yang membawa muatan ini.
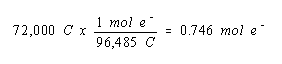
Persamaan setara untuk reaksi yang menghasilkan gas H 2 di katoda menunjukkan bahwa kita mendapatkan mol gas H 2 untuk setiap dua mol elektron.
| Katoda (-): | 2 H 2 O + 2 e – H 2 + 2 OH –  ” width=”17″ height=”9″> ” width=”17″ height=”9″> |
Oleh karena itu kami mendapatkan satu mol gas H 2 di katoda untuk setiap dua mol elektron yang mengalir melalui sel.
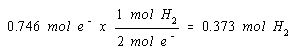
Kami sekarang memiliki informasi yang kami butuhkan untuk menghitung volume gas yang dihasilkan dalam reaksi ini.
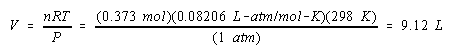
Contoh 2
Tentukan bilangan oksidasi kromium dalam garam yang tidak diketahui jika elektrolisis sampel cair garam ini selama 1,50 jam dengan arus 10,0 amp yang menyimpan 9,71 gram logam kromium di katoda.
Jawab :
Kita mulai, seperti sebelumnya, dengan menghitung jumlah mol elektron yang melewati sel selama elektrolisis.
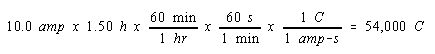
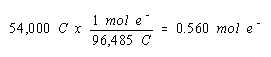
Karena kita tidak mengetahui persamaan setara untuk reaksi di katoda dalam sel ini, tampaknya tidak jelas bagaimana kita akan menggunakan informasi ini. Oleh karena itu, kami menuliskan hasil ini di lokasi yang mencolok, dan kembali ke pernyataan awal pertanyaan, untuk melihat apa lagi yang bisa dilakukan.
Masalahnya memberitahu kita massa kromium disimpan di katoda. Sekarang sudah jelas bahwa kita perlu mengubah informasi ini menjadi jumlah mol logam kromium yang dihasilkan.
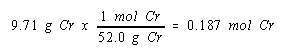
Kita sekarang mengetahui jumlah mol logam kromium yang dihasilkan dan jumlah mol elektron yang diperlukan untuk menghasilkan logam ini. Oleh karena itu, kita dapat melihat hubungan antara mol elektron yang dikonsumsi dalam reaksi ini dan mol kromium yang dihasilkan.
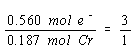
Tiga mol elektron dikonsumsi untuk setiap mol logam kromium yang dihasilkan. Satu-satunya cara untuk menjelaskan hal ini adalah dengan mengasumsikan bahwa reaksi bersih di katoda melibatkan reduksi ion Cr3+ menjadi logam kromium.
| Katoda (-): | Cr 3+ + 3 e – Cr ” width=”17″ height=”9″> ” width=”17″ height=”9″> |
Jadi, bilangan oksidasi kromium dalam garam yang tidak diketahui harus +3.
Contoh 3
Apa tiga komponen utama sel elektrolisis?
Tiga komponen utama sel elektrolitik meliputi katoda, anoda, dan elektrolit. Dalam sel elektrolisis (seperti yang terjadi pada kebanyakan sel elektrokimia), oksidasi terjadi di anoda dan reduksi terjadi di katoda.
Kesimpulan Pembahasan
Sel elektrolisis memiliki reaksi kimia endotermik. Reaksi tidak spontan sehingga diperlukan sumber listrik. Energi disimpan dalam sel elektrokimia. Energi itu dapat dilepaskan ketika sel dibiarkan berjalan dalam mode galvanik.
Pada prinsipnya, sel elektrolisis bipolar adalah sel elektrolisis garam cair yang dibagi menjadi beberapa sel elektrolisis. Kuantitas produksi magnesium dengan demikian meningkat bahkan di bawah arus konstan dibandingkan dengan IG Farben berbasis sel tunggal dan proses Dow.
Komposisi garam cair yang khas adalah 18–23% MgCl 2 , 55–58% NaCl, 20–25% CaCl 2 , dan 2% MgF 2. Kehilangan panas dari sel dapat dikurangi dan efisiensi pemanfaatan ruang sangat meningkat dibandingkan dengan sel tunggal. Oleh karena itu, produktivitas meningkat secara signifikan meskipun jumlah garam cair lebih sedikit.
