Daftar isi
Perbedaan Elektrolisis dan Sel Volta
Sel Volta
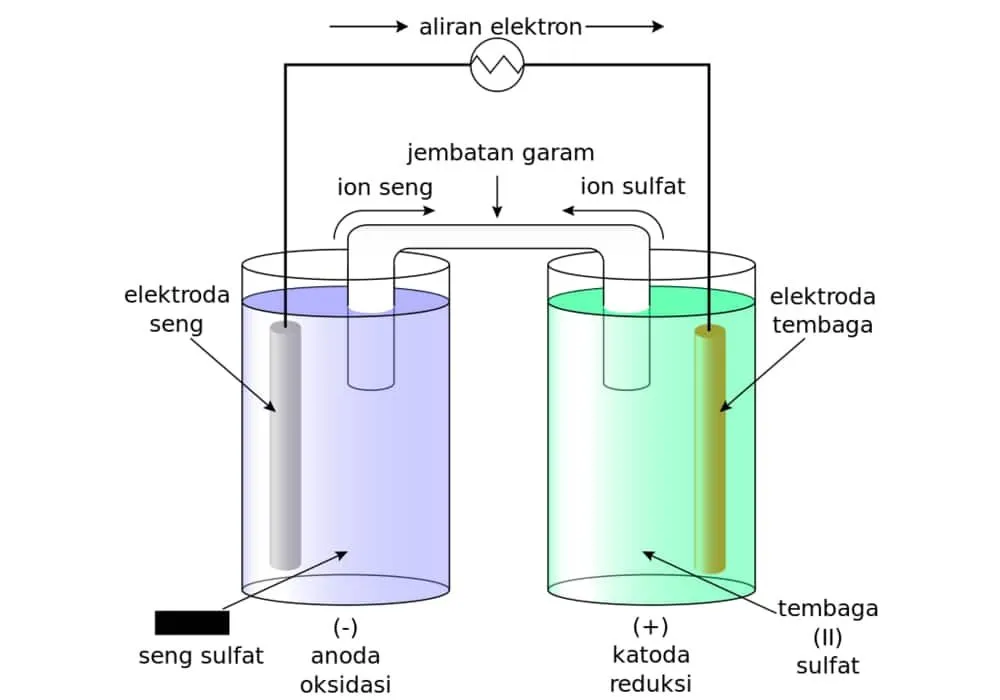
Sel volta memiliki nama lain yakni sel galvani. Sel volta merupakan salah satu jenis sel elektrokimia yang dapat mengubah energi kimia menjadi energi listrik melalui reaksi redoks spontan. Sel volta ini pertama kali ditemukan oleh ilmuwan bernama Alessandro Volta dan Luigi Galvani di Italia.
Sel volta terdiri dari dua elektroda yakni anoda (Zn) yang bermuatan negatif dan katoda (Cu) yang bermuatan positif. Anoda merupakan jenis elektroda yang terjadi ketika ada reaksi oksidasi, sedangkan katoda adalah reaksi reduksi elektroda.
Elektroda sendiri merupakan benda yang dapat menyalurkan arus listrik atau konduktor. Berikut beberapa contoh elektroda yang paling sering ditemui dalam kehidupan sehari-hari yaitu besi, platinum, emas, rhodium, nikel, perak, timah hitam, tembaga, seng, dan karbon.
Sel volta memiliki prinsip kerja dengan pemisahan dua bagian reaksi redoks, yaitu setengah reaksi oksidasi di anoda dan setengah reaksi reduksi di katoda. Elektroda yang masuk ke dalam larutan akan berubah menjadi Zn2+ apabila mengalami oksidasi. Endapan akan terbentuk apabila reduksi elektron yang terlepas diambil oleh Cu2+ dari larutan.
Sel Elektrolisis
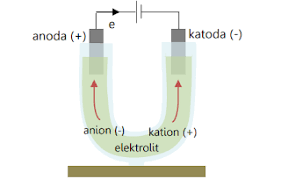
Sel elektrolisis merupakan reaksi yang dapat mengubah energi listrik menjadi energi kimia. Sel ini merupakan bagian dari sel elektrokimia yang dapat digunakan untuk mendorong reaksi redoks non-spontan melalui implementasi energi listrik.
Elektrolisis dalam bahasa Yunani memiliki arti ‘untuk memutuskan’, sehingga berdasarkan konsepnya elektrolisis dapat digunakan untuk menguraikan senyawa kimia dengan memanfaatkan arus listrik. Adapun empat komponen utama penyusun sel elektrolisis, berikut diantaranya.
- Elektrolit sebagai senyawa penghantar energi listrik.
- Sumber listrik sebagai penyuplai arus searah seperti baterai.
- Anode merupakan tempat terjadinya reaksi reduksi yang bermuatan positif dalam sel elektrolisis.
- Katode merupakan tempat terjadinya reaksi oksidasi yang bermuatan negatif dalam sel elektrolisis.
Sel elektrolisis memiliki prinsip kerja dengan menghubungkan sumber arah dari kutub negatif ke katode dan kutub positif ke anode. Selanjutnya terjadi kelebihan potential yang mendorong reaksi reduksi dan oksidasi non-spontan dapat berjalan.
Peristiwa tersebut kemudian mendorong elektron dapat mengalir dari katode ke anode dan ion-ion positif cenderung ke katode selanjutnya tereduksi, sementara itu ion-ion negatif tertarik menuju anode dan teroksidasi.
Perbedaan Elektrolisis dan Sel Volta
Berikut tujuh perbedaan antara sel volta dan sel elektolisis yang perlu diketahui.
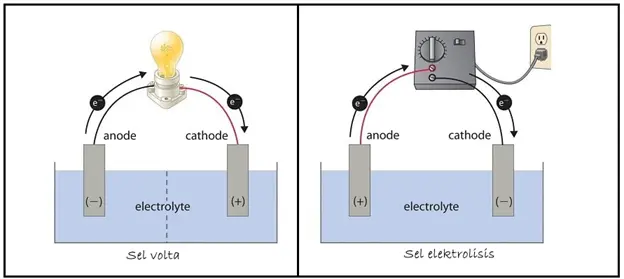
1. Arah Aliran Elektron
Sel volta berjalan secara spontan melalui kejadian redoks dapat memicu aliran elektron dari anoda yang bermuatan negatif menuju katoda yang bermuatan positif. Sebaliknya, pada sel elektrolisis yang dihasilkan oleh sumber arus listrik yang mengalir menuju katoda, baru kemudian menuju anoda yang bermuatan positif.
2. Jembatan Garam
Pada sel volta terdapat jembatan garam yang berguna untuk menjaga muatan cairan elektrolit supaya tetap netral. Apabila cairan elektrolit netral, maka proses redoks dapat berlangsung secara kontinu atau terus-menerus hingga menghasilkan arus listrik.
Sedangkan pada sel elektrolisis tidak dijumpai jembatan garam karena sumber energi listrik berasal dari luar yakni power supply. Hal tersebut mengakibatkan pergerakan ion-ion negatif akan bergerak mendekati anoda, dan ion-ion positif akan bergerak mendekati katoda.
3. Jenis Muatan Elektroda
Jenis muatan sel volta berbeda dengan sel elektrolisis. Pada sel volta, anoda yang bermuatan negatif dan katoda yang bermuatan positif. Sedangkan, pada sel elektrolisis, anoda yang bermuatan positif dan katoda yang bermuatan negatif.
Perbedaan jenis muatan elektroda antar sel tersebut disebabkan karena elektroda anoda dihubungkan dengan kutub positif power supply dan elektroda katoda dihubungkan dengan kutub negatif power supply.
4. Jenis Reaksi
Jenis reaksi sel volta berbeda dengan sel elektrolisis. Pada sel volta, reaksi dapat berlangsung spontan tanpa ada energi listrik dari luar, yakni murni melalui kejadian reduksi oksidasi atau redoks. Hal tersebut dapat diamati ketika lampu menyala tanpa ada power supply.
Sedangkan, dalam sel elektrolisis, reaksi berlangsung tidak dapat spontan, oleh karena itu memerlukan energi listrik dari luar untuk mendorong elektron di dalam. Sumber energi listrik tersebut didapatkan melalui power supply.
5. Kegunaan
Dalam segi kegunaan sel volta berbeda dengan sel elektrolisis. Sel volta berguna sebagai sumber arus energi listrik yang diwujudkan dalam kontruksi baterai pada benda elektronik, contohnya telepon seluler, mikrofon, kamera, remote AC dan lain sebagainya.
Sedangkan, dalam sel elektrolisis digunakan untuk melapisi suatu logam supaya terlihat lebih mengkilap. Sebagai contoh, pada proses penyepuhan pada emas yang telah pudar warnanya, memurnikan logam dari pengotor, dan pembuatan jenis-jenis gas untuk kepentingan industri.
6. Perubahan Energi
Selanjutnya perbedaan sel volta dan sel elektrolisis dari segi perubahan energi. Pada sel volta, terjadi reaksi kimia atau reduksi oksidasi yang menyebabkan aliran elektron dari anoda ke katoda. Kemudian aliran tersebut akan memproduksi kuat arus listrik sehingga terjadi perubahan energi kimia ke listrik.
Sementara itu, dalam sel elektrolisis, terjadi aliran arus listrik yang mengakibatkan aliran elektron dari power supply menuju ke katoda sehingga elektroda tersebut menjadi bermuatan negatif.
Hal ini mengakibatkan, ion-ion positif yang ada pada cairan elektrolit akan bergerak mendekati katoda dan mengalami reduksi, lalu ion-ion negatif akan bergerak mendekati anoda dan terjadi oksidasi. Peristiwa tersebut menyebabkan terjadinya perubahan energi listrik menjadi kimia.
7. Potensial Sel Standar
Pada sel volta memiliki potensial sel standar positif sebab sel ini dapat berjalan secara spontan. Sedangkan sel elektrolisis memiliki potensial sel standar negatif.
Penutup
Itulah tujuh perbedaan antara sel volta dan sel elektrolisis yang perlu diketahui. Adapun contoh rangkaian sel volta dan sel elektrolisis dalam satu perangkat yakni ketika HP sedang dicharge maka terjadis el elektrolisis, ketika HP sudah selesai di charge kemudian digunakan maka akan terjadi reaksi sel volta.
