Daftar isi
Pada materi kali ini kita akan membahas mengenai kalorimeter yang merupakan alat yang digunakan dalam mengukur dan menentukan sebuah kalori. Pembahasannya akan mencakup dari pengertian, sejarah, fungsi, jenis dan prinsip kerja dari alat kalorimeter.
Pengertian Kalorimeter
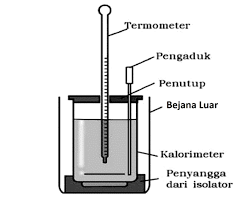
Kalorimeter merupakan suatu alat yang digunakan untuk menentukan kalori, caranya yaitu dengan mengukur perubahan suhu dan perubahan pada efe termal. Alat ini digunakan dalam beberapa percobaan yang ada kaitannya dengan kalori.
Kalorimeter memungkinkan berpindahnya kalor ke lingkungan sekitar tapi seminimum mungkin. Kalorimeter ini terdiri dari dua bejana yang dipisahkan oleh ruang udara. Bejana terbuat dari alumunium yang digunakan untuk mengurangi penyerapan kalor oleh dinding bejana.
Sedangkan, pada tutup bejana terbuat dari bahan kayu yang berguna untuk mengantarkan yang buruk agar tidak banyak panas yang hilang.
Sejarah Kalorimeter
Pada tahun 1780, salah satu bapak ahli kimia yang bernama Prancis A.L. Lavoisier menggunakan marmut untuk mengukur generasi panas dengan cara bernapas. Caranya yaitu menggunakan perangkat yang sama dengan kalorimeter.
Kemudian, panas yang dihasilkan oleh marmut percobaan dapat dilihat dari salju yang meleleh di sekitar perangkat. Kemudian para peneliti melakukan pengembangan kalorimeter dengan panas yang spesifik dari benda yang diukur dengan mencairnya es.
Kalorimeter ini terbuat dari kaca silinder yang dicat, dibawa pada tripod dan diakhiri menggunakan bagian dalam.
Fungsi Kalorimeter
- Kalorimeter berfungsi untuk mendeteksi suhu pada kalor.
- Kalorimeter berfungsi untuk mengukur jumlah dari kalor pada suatu perubahan reaksi kimia.
- Kalorimeter berfungsi untuk menghitung jumlah kalor pada suatu perubahan reaksi kimia.
- Kalorimeter berfungsi untuk alat peneliti percobaan pada suatu kalor.
- Sebagai alat pendeteksi kalor pada suatu perubahan reaksi kimia.
Jenis Kalorimeter
Kalorimeter dapat dibagi menjadi 2 jenis diantaranya yaitu kalorimeter sederhana dan kalorimeter bom. Berikut beberapa jenis dari kalorimeter yaitu:
Kalorimeter Sederhana
Kalorimeter sederhana ini biasanya digunakan untuk mengukur reaksi yang terjadi selama fase larutan. Pengukuran dari reaksi panas, selain panas pembakaran dapat dilakukan menggunakan kalorimeter tekanan tetap dan kalorimeter sederhana.
Di dalam kalorimeter sederhana ini telah respons panas yaitu jumlah dari panas yang diserap atau dilepaskan dengan solusi ketika panas diserap oleh kaca dan lingkungan diabaikan.
Rumus dari kalorimeter sederhana yaitu:
qreaksi = - (qlarutan + qkalorimeter)
qkalorimeter = Ckalorimeter x DT
qlarutan = m x c x DT
Kalorimeter Bom
Kalorimeter ini merupakan kalorimeter yang khusu digunakan dalam menentukan respons pembakaran panas. Reaksi pembakaran bom dapat menyebabkan panas dan penyerapan air dan bom. Hal ini dikarenakan tidak ada panas pada daerah tersebut.
Rumus dari kalorimeter bom yaitu:
qreaksi = - (qair + qbom)
qair = m x c x DT
qbom = Cbom x DT
Prinsip Kerja Kalorimeter
Prinsip kerja dari alat kalorimeter yaitu mengalirkan arus listrik kepada kumparan kawat penghantar yang kemudian dimasukkan ke dalam air suling. Pada saat bergerak di dalam kawat penghantar akan membawa muatan yang betumbukan dengan atom logam dan akan kehilangan energi.
Oleh karena hal tersebut, pembawa muatan bertumbukan dengan kecepatan yang konstan dan sebanding dengan kuat dari medan listriknya. Tumbukan tersebut dapat menyebabkan logam yang dialiri arus listrik mendapatkan energi yaitu energi panas.
Semakin besar nilai dari tegangan dan arus listrik pada bahan makan panas listrik yang dimiliki oleh bahan tersebut semakin kecil. Hal ini merupakan suatu anggapan yang salah dikarenakan di dalam pengukuran yang pertama, perubahan suhu yang digunakan sangat kecil.
Namun, jika perubahan suhu itu sama besarnya, maka yang berarus kecil memiliki tara panas listrik yang besar.
Contoh Soal Kalorimeter
1. Sebanyak 2 g naftalena (C10H8), zat yang berbau tajam dan biasa digunakan untuk mengusir ngengat, dibakar dalam kalorimeter bom. Dari hasil pengamatan, suhu air dalam kalorimeter naik sebesar 5°C. Jika kapasitas kalor kalorimeter adalah 10,17 kJ/°C, tentukanlah perubahan entalpi pada reaksi tersebut!
Penyelesaian:
Diketahui: Massa naftalena (m) = 2 g
Massa molar naftalena (Mr) = 128 g/mol
Mol naftalena = 2/8 mol
Kapasitas kalor kalorimeter (C) = 10,17 kJ/K
Perubahan suhu (ΔT ) = 5°C
Ditanya ΔH?
Jawab:

2. 50 mL larutan HCl 1M yang suhunya 22°C dicampurkan dengan 50 mL larutan NaOH 1 M yang suhunya 22°C. Pada reaksi tersebut terjadi kenaikan suhu sampai 28,87°C. Tentukan, ΔH netralisasi dan tulis persamaan termokimia reaksi tersebut.
Penyelesaian:
Jumlah mol HCl = 50 mL x 1 M = 50 mmol = 0,05 mol
Jumlah mol NaOH = 50 mL x 1 M = 50 mmol = 0,05 mol
Volum larutan = volum air = 100 mL
Massa larutan = massa air = 100 mL x 1 gm/L = 100 g

