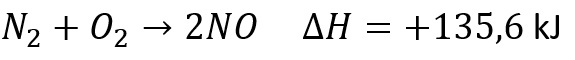Daftar isi
Pada reaksi kimia tidak hanya ada reaksi reduksi oksidasi yang digunakan untuk menyeimbangkan persamaan reaksi, namun juga terdapat perubahan kalor.
Pada kali ini, materi yang membahas perubahan kalor tersebut adalah termokimia.
Berikut penjelasan terkait termokimia mulai dari pengertian, jenis, dan beberapa contoh soal sekaligus pembahasannya.
Pengertian Termokimia
Termokimia merupakan cabang ilmu dari kimia yang mempelajari tentang perubahan panas atau kalor dari proses kimia atau pun fisika.
Adanya perubahan kalor ini dikarenakan partikel partikel pada suatu zat selalu bergerak dan menghasilkan energi kinetik.
Energi tersebut menghasilkan panas sehingga selalu terjadi perubahan kalor pada setiap reaksi kimia.
Beberapa penerapan termokimia di kehidupan sehari-hari antara lain adalah adanya reaksi kimia pada sistem tubuh.
Tubuh menghasilkan energi untuk tubuh kita sehingga terjadi perpindahan kalor.
Selain itu, ada juga pembakaran dari bahan bakar minyak dan batu bara pada pembangkit listrik.
Mobil yang dapat berjalan juga merupakan penerapan termokimia yang membakar bensin unatuk menghasilkan energi gerak.
Ada pula kompor yang memerlukan gas untuk menghasilkan panas yang berguna saat memasak.
Persamaan Termokimia
Persamaan termokimia didefinisikan sebagai persamaan reaksi yang setara dengan cara menyetarakan kalor reaksi dimana kalor reaksi adalah hubungan perbandingan antara massa dan energi.
Berikut salah satu persamaan termokimia
2H2(g) + O2(g) → 2H2O(g) ΔH= −483,6 kJ
Pada persamaan termokimia juga terdapat istilah entalpi. Entalpi diartikan sebagai fungsi keadaan yaitu jumlah energi dalam dan hasil kali dari tekanan dengan volume sistem.
Perubahan Entalpi
Perubahan entalpi dinotasikan dengan ΔH. Ketika tekanan konstan, perubahan entalpi memiliki nilai yang sama dengan kalor reaksi. Berikut persamaan entalpi
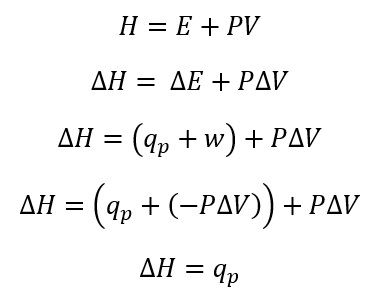
Nilai entalpi bergantung pada H awal dan H akhir atau bergantung pada keadaan reaktan dan produk.
Sedangkan tanda pada nilai entalpi bergantung pada keadaan apakah kalor pada reaksi kimia diserap atau dilepas.
Jika bertanda negatif maka kalor dilepasa dan positif untuk kalor yang diterima.
Reaksi dikatakan eksoterm ketika suartu reaksi melepas kalor dan dikatakan endoterm ketika sistem menerima kalor.
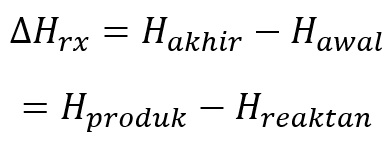
Jenis Perubahan Entalpi Standar
Berikut beberapa jenis perubahan entalpi standar
- Perubahan Entalpi Pembentukan Standar
Didefinisikan sebagai perubahan entalpi ketika 1 mol senyawa terbentuk dari unsur ketika kondisi suatu persamaan adalah standar.
Contohnya adalah perubahan entalpi pembentukan 1 mol H2O dari gas H2O dengan O2 adalah -285,9 kJ/mol
Persamaan reaksinya ditulis sebagai berikut

- Perubahan Entalpi Pembakaran Standar
Didefinisikan sebagai perubahan entalpi jika 1 mol suatu zat dibakar dengan sempurna pada kondisi standar.
Sebagai contoh adalah perubahan entalpi pembentukan 1 mol C2H6 adalah -1559,5 kJ/mol
Persamaan reaksinya adalah sebagai berikut
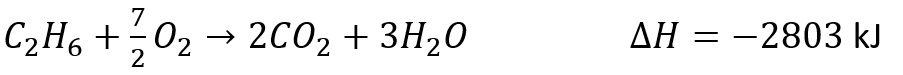
- Perubahan Entalpi Pengatoman Unsur Standar
Didefinisikan sebagai perubahan entalpi jika 1 mol gas dihasilkan dari unsur dalam bentuk fisik dengan kondisi standar.
Reaksi atomisasi selalu bernilai positif atau endoterm karena pada reaksi selalu dibutuhkan kalor.
Sebagai contoh adalah pengatoman unsur hydrogen.
Persamaan termokimianya adalah sebagaiberikut.
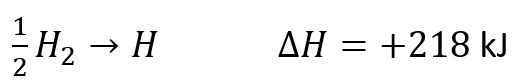
- Perubahan Entalpi Pengatoman Senyawa Standar
Didefinisikan sebagai perubahan entalpi jika 1 mol senyawa berubah menjadi atom dalam bentuk gas dengan keadaan standar. Contohnya adalah proses pengatoman metana
Persamaan termokimia tersebut adalahsebagai berikut

- Perubahan Entalpi Pelarutan Standar
Didefinisikan sebagai perubahan entalpi 1 mol senyawa yang diubah menjadi larutan dalam keadaan standar. Contohnya adalah pelarutan NaOH
Persamaan termokimianya adalah sebagai berikut
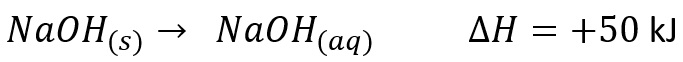
- Perubahan Entalpi Peleburan Standar
Didefinisikan sebagai perubahan entalpi pada peleburan 1 mol zat padat menjadi zat cair dan mencapai titik leburnya dengan tekanan standar. Contohnya adalah peleburan es.
Persamaan termokimianya adalah

- Perubahan Entalpi Penguapan Standar
Didefinisikan sebagai perubahan entalpi pada penguapan 1 mol zat cair menjadi gas ketika mencapai titik didihnya. Contohnya adalah penguapan air.
Persamaan termokimianya adalah

Contoh Soal dan Pembahasan
1. Diketahui 1 mol NO terurai menjadi unsur pembentuknya dengan melepas kalor sebesar 90,4 kJ. Berapa perubahan entalpi reaksi pembentukan 1,5 mol zat tersebut dan bagaimana reaksi termokimianya?
Jawab
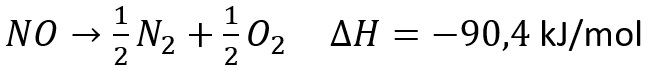
Untuk 1,5 mol NO perubahan entalpinya sebesar 1,5 x 90,4 = 135,6 kJ
Maka persamaan reaksinya menjadi