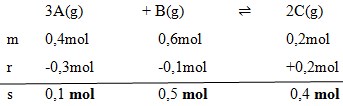Daftar isi
Dalam ilmu kimia kita akan mempelajari mengenai kesetimbangan, lalu apa itu kesetimbangan kimia? Berikut penjelasannya.
Pengertian Kesetimbangan Kimia
Kesetimbangan kimia merupakan keadaan di mana reaktan dan produk hadir dalam konsentrasi yang tidak memiliki kecenderungan untuk berubah, sehingga tidak ada perubahan yang dapat diamati pada sifat-sifatnya.
Keadaan ini terjadi ketika reaksi maju berlangsung pada kecepatan yang sama dengan reaksi balik.
Laju reaksi pada reaksi maju dan mundur umumnya adalah sama. Sehingga tidak ada perubahan dalam konsentrasi reaktan dan produk.
Konsep kesetimbangan kimia dikembangkan setelah Berthollet (1803) yang menemukan bahwa beberapa reaksi kimia bersifat reversibel.
Untuk setiap campuran reaksi yang ada pada kesetimbangan, laju pada reaksi maju dan mundur adalah sama.
α A + β B = σ S + τ T
Dalam persamaan berikut ini A dan B adalah spesi reaktan kimia, S dan T adalah spesi produk, dan α, β, σ, dan τ adalah koefisien stoikiometri dari reaktan dan produk tersebut.
Ciri-ciri Kesetimbangan Kimia
Berikut akan dipaparkan mengenai ciri-ciri dari kesetimbangan kimia:
- Reaksi yang terjadi berada di dalam tempat yang tertutup ini juga memiliki suhu serta tekanan yang tidak berubah-ubah atau konstan.
- Keberlangsungan reaksi yang bersifat dinamis atau terus-menerus dan terjadi dalam arah yang akan berlawanan antara keduanya.
- Terdapat kesamaan pada laju reaksi ke reaktan dengan laju reaksi ke produknya.
- Tidak terdapat perubahan dalam konsentrasi produk dan reaktan. Dengan kata lain konsentrasi pada produk dan reaktan akan bersifat tetap.
- Reaksi ini juga terjadi secara mikroskropis dalam tingkat partikel sebuah zat.
Hukum Kesetimbangan Kimia
Hukum kesetimbangan kimia atau yang lebih dikenal sebagai tetapan kesetimbangan merupakan perbandingan dari hasil konsentrasi produk berpangkat koefisiennya masing-masing dan konsentrasi reaktat berpangkat koefisiennya masing-masing.
Tetapan kesetimbangan memiliki simbol K atau Kc.
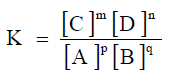
Rumusan ini disebut dengan hukum kesetimbangan yang bila dalam suatu reaksi dalam keadaan setimbang, maka dapat diperoleh hasil kali dari konsentrasi.
Zat-zat hasil reaksi dipangkatkan koefisiennya kemudian dibagi dengan hasil kali konsentrasi zat-zat pereaksi dipangkatkan koefisiennya akan mempunyai harga konstan.
Tetapan kesetimbangan dalam reaksi merupakan ciri khas untuk suatu reaksi dan harganya konstan pada suhu tertentu.
Itu berarti setiap reaksi akan mempunyai harga tetapan kesetimbangan yang cenderung tidak akan sama dengan reaksi yang lain meskipun suhunya sama dan untuk suatu reaksi yang sama harga K akan berubah jika suhunya berubah.
Faktor Kesetimbangan Kimia
1. Katalis
Katalis adalah zat yang ditambahkan ke dalam larutan untuk mempercepat laju reaksinya.
Penambahan katalis tidak mempengaruhi kesetimbangan, karena katalis hanya mempercepat tercapainya kesetimbangan.
2. Tekanan dan Volume
Pengaruh tekanan berkebalikan dengan volume. Perubahan tekanan dan volume tidak mengakibatkan perubahan harga K.
- Apabila tekanan diperbesar, maka volume akan mengecil dan kesetimbangan akan bergeser ke arah zat yang jumlah koefisiennya lebih kecil.
- Apabila tekanan diperkecil maka volume akan membesar dan kesetimbangan akan bergeser ke arah zat yang jumlah koefisiennya lebih besar.
3. Suhu
Perubahan suhu berpengaruh pada kesetimbangan eksoterm dan endoterm. Perubahan suhu mengakibatkan perubahan pada harga K
- Kenaikan suhu mengakibatkan kesetimbangan bergeser ke arah endoterm. Pada reaksi endoterm (ΔH > 0) Peningkatan suhu mengakibatkan harga K semakin besar dan Pada reaksi eksoterm (ΔH < 0) peningkatan suhu mebakibatkan harga K semakin kecil.
- Penurunan suhu akan mengakibatkan kesetimbangan bergeser kearah eksoterm. Penurunan suhu mengakibatkan harga K semakin kecil dan Penurunan suhu mengakibatkan harga K semakin besar.
4. Konsentrasi
Perubahan konsentrasi tidak mengakibatkan perubahan harga K.
- Jika konsentrasi diperbesar, kesetimbangan akan bergeser dari arah zat yang konsentrasinya diperbesar menuju konsentrasi yang lebih kecil.
- Jika konsentrasi diperkecil, kesetimbangan akan bergeser ke arah zat yang konsentrasinya diperkecil menuju ke arah yang konsentrasinya lebih kecil.
Rumus Kesetimbangan Kimia
Berikut Rumus Kesetimbangan Kimia dan akan dijabarkan tetapan kimianya:
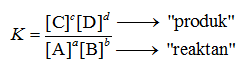
Tetapan Kesetimbangan Konsentrasi (Kc)
Tetapan merupakan konsentrasi reaktan dan produk. Harga Kc bergantung pada reaksi yang merupakan reaksi kesetimbangan homogen atau reaksi kesetimbangan heterogen.
Rumus Reaksi kesetimbangan homogen :
pA (g) + qB (g) ⇄ rC (g) + sD (g)
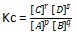
Rumus Reaksi kesetimbangan heterogen :
pA (g) + qB (s) ⇄ rC (g) + sD (g)
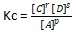
Ketentuan Reaksi heterogen dalam menghitung Kc :
- Dalam fase gas dan padat maka penentu Kc adalah fase gas
- Dalam fase gas dan cair maka penentu Kc adalah fase gas
- Dalam fase padat dan larutan maka penentu Kc adalah fase gas
- Dalam fase gas, cair, dan padat maka penentu Kc adalah fase gas
Tetapan Kesetimbangan Tekanan (Kp)
Tetapan merupakan tekanan reaktan dan produk. Harga Kp bergantung pada zat yang memiliki fase gas pada reaksi homogen dan reaksi heterogen.
Rumus Kp :
pA (g) + qB (g) ⇄ rC (g) + sD (g)
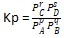
Keterangan :
- PA = tekanan parsial zat A
- PB = tekanan parsial zat B
- PC = tekanan parsial zat C
- PD = tekanan parsial zat D
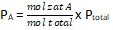
Maka dapat ditarik kesimpulan, bahwa perhitungan Kc dan Kp terdapat hubungan di antara keduanya. Hal tersebut diperoleh berdasarkan persamaan gas ideal :
P . V = n . R . T ↔ P = n/v . R . T ↔ P = M . R . T
Sehingga berdasarkan reaksi kesetimbangan akan dihasilkan :
pA (g) + qB (g) ⇄ rC (g) + sD (g)
dan memperoleh rumus :

Kp = Kc . (R.T)(r+s)-(p+q)
Contoh Soal dan Pembahasan
Soal 1
Dalam ruang 1 liter terdapat 1 mol gas HI yang terurai menurut reaksi:
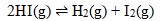
Harga Kc pada saat itu adalah 4, jumlah gas H2 yang ada pada saat setimbang adalah…
a. 0,8 mol
b. 0,6 mol
c. 0,5 mol
d. 0,4 mol
e. 0,2 mol
Jawaban :
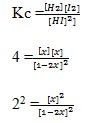
2 – 4x = x
2 = 5x
x = 0,4 mol
Soal 2
Gas A,B, dan C masing-masing 0,4 mol, 0,6 ,mol, dan 0,2 mol dicampurkan dalam ruang tertutup dan terjadi reaksi kesetimbangan:
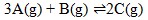
Pada saat setimbang 0,3 mol gas A telah bereaksi, maka gas B yang ada dalam keadaan setimbang adalah…
a. 0,5 mol
b. 0,4 mol
c. 0,3 mol
d. 0,2 mol
e. 0,1 mol
Jawaban :
Dengan menggunakan perbandingan koefisien maka :