Daftar isi
Senyawa yang bereaksi ternyata juga memiliki laju reaksi. Laju reaksi ini secara singkat adalah perubahan konsentrasi reaktan.
Banyak faktor yang juga mempengaruhi laju suatu reaksi.
Pada pembahasan kali ini, materi yang akan didalami adalah laju reaksi beserta komponen materi lainnya seperti faktor yang mempengaruhi, teori tumbukan, hukum laju, dan beberapa contoh soal dan pembahasan.
Teori Tumbukan Laju Reaksi
Teori tumbukan adalah teori yang menyatakan bahwa setiap partikel pada reaktan saling bertumbukan untuk bereaksi.
Tumbukan tersebut menghasilkan reaksi yang dikenal dengan tumbukan efektif.
Pada proses tumbukan tersebut, dibutuhkan energi minimum untuk menghasilkan tumbukan yang efektif.
Energi minimum ini disebut energi aktivasi yang disimbolkan dengan Ea.
Laju reaksi juga bergantung kepada beberapa hal diantaranya:
1. Arah tumbukan partikel
Partikel harus memiliki orientasi atau arah tertentu dalam proses bertumbukan sehingga tumbukan yang dihasilkan efektif.
Contoh tumbukan yang memungkinkan terjadinya tumbukan efektif adalah pergerakan molekul gas NO dengan molekul gas NO3 dengan persamaan reaksi
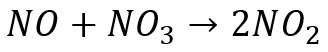
2. Frekuensi tumbukan partikel
Semakin tinggi frekuensi tumbukan partikel maka semakin besar pula peluang terjadinya tumbukan efektif.
Dengan demikian laju reaksi juga akan semakin cepat.
3. Energi partikel
Agar menghasilkan tumbukan yang efektif energi partikel reaktan harus melampaui energi aktivasi.
Pengertian Laju Reaksi
Laju reaksi didefinisikan sebagai adanya perubahan pada konsentrasi yang dimiliki oleh reaktan atau produk per satuan waktu.
Rumus persamaan reaksi untuk reaktan A dan B yang menghasilkan produk C dan D adalah sebagai berikut.
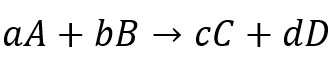
Faktor-faktor yang Mempengaruhi Laju Reaksi
Berikut faktor yang mempengaruhi laju reaksi.
1. Konsentrasi Reaktan
Jika konsentrasi suatu reaktan semakin tinggi, maka semakin banyak pula jumlah partikel yang ikut terlibat dalam tumbukan.
Akibatnya, semakin tinggi pula frekuensi terjadinya tumbukan yang akhirnya menyebabkan laju reaksi menjadi semakin cepat.
Sebagai contoh, reaksi yang terjadi pada korosi besi karena udara. Laju reaksi besi lebih cepat jika udara memiliki kelembaban yang tinggi atau dapat dikatakan ketika konsentrasi reaktan H2O lebih tinggi.
2. Wujud Fisik Reaktan
Jika reaktan yang bereaksi memiliki wujud yang sama, maka laju reaksi bergantung pada gerak acak dari unsur reaktan tersebut.
Sedangkan, jika reaktan yang bereaksi memiliki wujud yang berbeda satu sama lain, maka tumbukan efektif didapatkan pada bagian antarfasa.
Dengan demikian, reaktan dengan wujud yang berbeda tentunya dibatasi oleh luas permukaan dari reaktan.
Oleh sebab itu, jika luas permukaan semakin luas maka frekuensi terjadinya tumbukan yang efektif juga semakin meningkat.
Contohnya adalah reaksi yang terjadi pada pembakaran kayu. Kayu akan lebih cepat terbakar ketika kayu telah dipotong potong jika dibandingkan dengan kayu gelondongan.
3. Temperatur
Pada temperature yang semakin tinggi, energi kinetik dari partikel reaktan juga semakin tinggi.
Alhasil, frekuensi terjadinya tumbukan juga akan semakin meningkat.
Dapat dikatakan, semakin tinggi temperature mengakibatkan laju reaksi yang juga semakin cepat.
Contohnya, glowing stick akan menyala lebih cepat dan terang di dalam air yang panas dibandingkan pada air dengan suhu yang rendah.
4. Keberadaan Katalis
Katalis sering digunakan untuk mempercepat laju reaksi. Keberadaan katalis menyebabkan energi aktivasi reaktan menjadi lebih rendah sehingga laju reaksi menjadi lebih cepat.
Hukum Laju Reaksi
Hukum laju reaksi menyatakan adanya hubungan antara laju reaksi dengan konsentrasi dari reaktan yang dipangkatkan dengan bilangan tertentu. Jika suatu reaksi memiliki persamaan
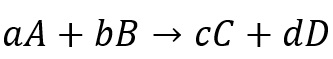
Maka hukum laju reaksi adalah
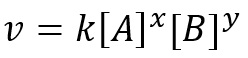
dengan nilai konstanta laju adalah k, dan nilai x dan y merupakan konstanta yang didapatkan berdasarkan eksperimen.
Pada reaksi tersebut, reaksi orde ke-x terhadap A, orde ke-y terhadap B, dan orde reaksi total sama dengan x + y.
Manfaat Laju Reaksi
Berikut beberapa manfaat laju reaksi di berbagai bidang.
- Penggunaan enzim di dalam bidang industri. Salah satunya dalam pembuatan keju.
- Penggunaan enzim dalam pembuatan roti
- Pembuatan ammonia dengan proses Haber-Bosch
- Pembuatan asam sulfat dengan proses kontak
- Industri asam nitrat
- Industri perminyakan.
Contoh Soal dan Pembahasan
1. Tentukan laju reaksi pada suhu 90 derajat Celcius jika pada suhu 30 derajat Celcius laju reaksi sebesar 6 x 10-3 M/det. (Laju reaksi umumnya meningkat dua kali lipat jika temperatur naik 10 derajat Celcius)
Jawab:
a = 2, T = 10, T1 = 30, T2 = 90, V0 = 6 x 10-3 M/det
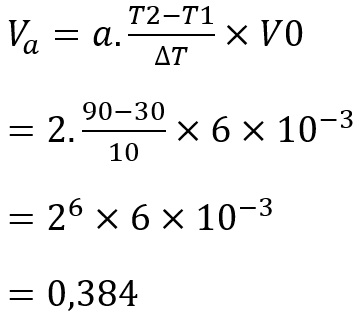
2. Jika suatu reaksi kimia dituliskan sebagai berikut
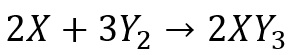
Maka dinyatakan sebagai….
Jawab:
Berkurangnya konsentrasi X per satuan waktu
Berkurangnya konsntrasi Y2 per satuan waktu
Bertambahnya konsentrasi XY3 per satuan waktu.
