Daftar isi
Entalpi digunakan untuk menghitung jumlah kalor yang berpindah dari atau ke sistem pada tekanan tetap. Nilai entalpi tidak dapat diukur, yang dapat diukur adalah perubahannya ( ΔH ).
Perubahan entalpi standar dapat dibedakan menjadi 3, yaitu :
Jenis perubahan entalpi standar
Perubahan entalpi pembentukan standar ( ΔHfo )
kalor (energi) yang dibutuhkan atau dilepas pada peristiwa pembentukan 1 mol senyawa dari unsur-unsur pembentukannya.
Contoh : 1/2 N2(g) + 1/2 O2(g) -> NO(g) ΔHfo + ΔHfo = +90 kJ/mol
Perubahan entalpi penguraian (ΔHdo)
Kalor (energi) yang dibutuhkan atau dilepas pada peristiwa penguraian 1 mol senyawa menjadi unsur-unsur pembentukannya.
Contoh : H2O + 1/2 O2 ΔHdo = +286 kJ/mol
Perubahan entalpi pembakaran ( ΔHco )
Kalor (energi) yang dibutuhkan atau dilepas pada peristiwa pembakaran 1 mol senyawa atau 1 mol unsur. Contoh : C3H8 + 5 O2 -> 3 Co2 + 4 H2O ΔHco = +75 kJ/mol.
Rumus Penentuan entalpi reaksi
Besarnya entalpi dapat ditentukan dengan cara berikut ini :
1. Menggunakan kalorimeter
Kalorimeter adalah alat untuk menentukan ΔH reaksi melalui pengukuran kalor reaksi. Jumlah kalor yang diserap oleh air di dalam kalorimeter.
- kalor jenis
q = m x c x ΔT
- kapasitas kalor
qkalorimeter = C x ΔT
q=kalor reaksi (J), m=massa zat pereaksi (g), c = kalor jenis air (J g-1 K-1 ), C = kapasitas kalor dari bom calorimeter ( J k-1)
ΔT = suhuakhir – suhumula-mula (K)
2. Menggunakan hukum Hess (hukum penjumlahan kalor)
Perubahan entalpi yang terjadi pada suatu reaksi hanya tergantung pada keadaan mula-mula dan keadaan akhir reaksi, tidak tergantung pada proses reaksinya.
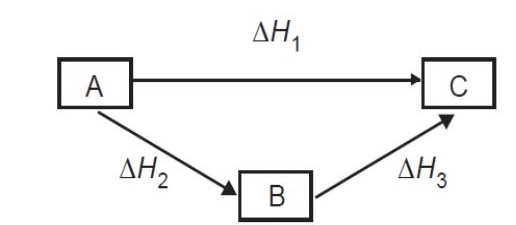
ΔH = ΔH1 + ΔH2
ΔH = perubahan entalpi keseluruhan
ΔH1 = perubahan entalpi tahap 1
ΔH2 = perubahan entalpi tahap 2
ΔH3 = perubahan entalpi tahap 3
3. Berdasarkan data entalpi pembentukan ( Hf )
Jika diketahui ΔH0f, makan ΔH dapat dikatakan dengan menggunakan rumus :
ΔH reaksi = Σ ΔHof produk – Σ ΔHof reaktan
ΔH reaksi = kanan – kiri
4. Menggunakan data energi ikatan
energi ikatan adalah energi yang dibutuhkan untuk memutus 1 mol ikatan antar atom tiap mol suatu zat dalam keadaan gas.
- Energi ikatan rata-rata
energi rata-rata yang dibutuhkan untuk memutuskan 1 mol senyawa gas menjadi atom-atomnya untuk lebih dari tiga atom dalam molekulnya. Jika diketahui energi ikat (EI), maka :
ΔHreaksi = Σ EI pemutusan – Σ EI pembentukan
ΔH = kiri – kanan
Untuk menyelesaikan soal, umumny akan diberi tahu berap energi ikatan masing-masing molekul jadi kita tidak diharuskan menghafal data energi ikatan.
- Energi atomisasi
Energi yang dibutuhkan untuk memutus molekul kompleks dalam 1 mol senyawa menjadi atom-atom gasnya.
ΔH atomisasi = Σ energi ikatan
