Seperti yang kita ketahui sebelumnya, pengertian dari sel volta adalah serangkaian alat yang menghasilkan listrik dengan memanfaatkan reaksi redoks spontan dimana terjadi perpindahan elektron melalui lintasan luar.
Sel volta terdiri atas beberapa susunan yaitu berupa anoda dan katoda, larutan elektrolit, serta jembatan garam sebagai media pengantar antara kedua larutan.
Sel Volta biasa digunakan untuk menciptakan sebuah arus listrik untuk menghidupkan peralatan elektronik. Lalu bagaimana cara kerja atau prinsip kerja adari sel volta sampai dapat menciptak aliran listrik?
Untuk menjadikan sebuah sel volta menjadi aliran listrik, dibutuhkan sebuah rangkaian yang terdiri dari :
- Anode, yaitu elektrode tempat terjadinya reaksi oksidasi.
- Katode, yaitu elektrode tempat terjadinya reaksi reduksi.
- Elektrolit, yaitu zat yang dapat menghantarkan listrik.
- Rangkaian luar, yaitu kawat konduktor yang menghubungkan anode dengan katode.
- Jembatan garam, yaitu rangkaian dalam yang terdiri dari larutan garam. Jembatan garam memungkinkan adanya aliran ion-ion dari setengah sel anode ke setengah sel katode, dan sebaliknya sehingga terbentuk rangkaian listrik tertutup.
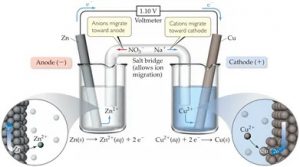
Logam Zn dan Cu yang menjadi kutub-kutub listrik pada sel volta di atas disebut sebagai elektrode. Logam Zn tempat terjadinya oksidasi Zn disebut anoda. Logam Cu tempat terjadinya reduksi ion Cu2+ disebut katoda.
Oleh karena elektron dilepas dari reaksi oksidasi di anoda menuju reaksi reduksi di katoda, maka anoda adalah kutub negatif dan katoda adalah kutub positif. Unruk kemudain kedua kompartemen tersebut dhubungkan dengan jembatan garam.
Adapun fungsi dari jembatan tersebut adalah untuk menetralkan muatan listrik dari kedua kompartemen setelah reaksi redoks dengan menyuplai anion ke kompartemen anoda dan kation ke kompartemen katoda; serta memungkinkan terjadinya migrasi ion-ion pada kedua kompartemen sehingga membentuk rangkaian listrik tertutup.
Pada gambar sel volta di atas, dengan jembatan garam KNO3, ion NO3− akan bergerak ke arah anoda untuk menetralkan ion Zn2+ berlebih dari hasil oksidasi Zn; dan ion K+ akan bergerak ke arah katoda untuk menetralkan ion SO42− berlebih dari larutan CuSO4 oleh karena berkurangnya ion Cu2+ setelah tereduksi menjadi logam Cu. Untuk mengukur aliran listrik pada sel volta sendiri kita bisa menggunakan voltmeter seperti pada gambar di atas.
