Daftar isi
Pembahasan kali ini tentang reaksi reduksi dan oksidasi yang terjadi pada suatu reaksi kimia.
Reaksi reduksi oksidasi secara singkat adalah proses perubahan bilangan oksidasi dari atom yang ada dalam sebuah reaksi kimia.
Lebih jelasnya, pembahasan tentang reaksi reduksi oksidasi akan di terangkan di bawah ini.
Pengertian Reaksi Reduksi Oksidasi
Reaksi reduksi adalah proses menambahkan elektron dari suatu atom, molekul, atau pun ion.
Sedangkan reaksi oksidasi adalah proses pelepasan elektron sebuah molekul, ion atau atom.
Kedua proses ini tidak dapat dipisahkan karena saling membantu penyetaraan pada sebuah reaksi kimia.
Ada pula istilah oksidator dan reduktor pada reaksi redoks. Oksidator adalah zat atau agen yang mengalami reaksi oksidasi. Oksidator memiliki bilangan oksidasi atau memiliki sifat keelektronegatifan yang tinggi.
Beberapa contoh oksidator adalah H2O2, CrO3, dan OSO4.
Sedangkan reduktor adalah senyawa yang melakukan reduksi ke senyawa lain. Reduktor bekerja sebagai penderma atau melepaskan elektron untuk senyawa lain yang membutuhkan.
Umumnya reduktor adalah senyawa-senyawa logam seperti Li, Fe, Al, Mg, dan Zn.
Penyetaraan Reaksi Reduksi Oksidasi
Penyetaraan reaksi redoks terbagi menjadi dua jenis yaitu
- Metode bilangan oksidasi
- Metode setengah reaksi
1. Metode Bilangan Oksidasi
Berikut langkah-langkah penyetaraan menggunakan metode bilangan oksidasi.
- Tentukan terlebih dahulu unsur atau senyawa yang akan menjadi oksidator yaitu yang mengalami proses oksidasi.
- Tentukan pula unsur yang menjadi reduktor sesuai bilangan oksidasi masing-masing unsur
- Setarakan jumlah unsur yang mengalami reaksi redoks.
- Tentukan banyaknya nilai kenaikan atau pelepasan dari bilangan oksidasi unsur-unsur yang mengalami perubahan bilangan oksidasi
- Menambahkan koefisien yang tepat untuk menyetarakan perubahan bilangan oksidasi
- Menyetarakan jumlah atom H dan O pada unsur lainnya.
2. Metode Setengah Reaksi
Berikut langkah-langkah penyetaraan reaksi menggunakan metode setengah reaksi.
- Tuliskan zat-zat yang mengalami reaksi reduksi oksidasi
- Membagi reaksi menjadi setengah reaksi reduksi dan setengah reaksi oksidasi
- Melakukan penyetaraan atom yang mengalami reaksi redoks, namun tidak pada atom H dan O
- Melakukan penyetaraan atom O dengan menambahkan H2O ke unsur atau senyawa yang kekurangan oksigen
- Melakukan penyetaraan atom H dengan menambahkan H+ ke unsur atau senyawa yang membutuhkan atom H
- Melakukan penyetaraan muatan dengan menambahkan elektron ke unsur atau senyawa yang lebih positif
- Menyetarakan jumlah elektron pada kedua persamaan setengah reaksi reduksi dan oksida
- Menggabungkan kembali kedua persamaan setengah reaksi menjadi reaksi utuh.
Contoh Soal dan Pembahasan
1.Tentukan unsur-unsur yang termasuk reduktor, oksidator, hasil reduksi, dan hasil oksidasi pada persamaan berikut ini

Jawab:
Oksidator = HCl
Reduktor = Fe
Hasil oksidasi = FeCl3
Hasil reduksi = H2
2.Gunakan metode bilangan oksidasi untuk menyetarakan persamaan reaksi redoks berikut ini
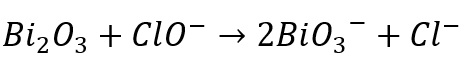
Jawab:
Samakan muatan kiri dan kanan:

Samakan jumlah atom masing-masing sisi
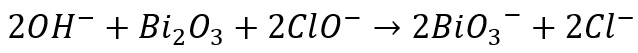
Maka diperoleh reaksi setara:

