Larutan ternyata memiliki sifat khusus yang hanya bergantung pada jumlahnya (kuantitas partikel zat tertentu).
Penjelasan lebih lanjut mengenai pengertian, sifat, rumus, dan beberapa contoh soal beserta pembahasannya adalah sebagai berikut.
Pengertian Sifat Koligatif Larutan
Sifat koligatif larutan adalah sifat larutan yang hanya bergantung pada jumlah suatu zat atau partikel dan tidak bergantung pada jenis atau identitas dari larutan tersebut.
Sifat larutan yang bergantung pada jenis zat terlarut adalah rasa, warna, viskositas, dan keasaman.
Sebagai contoh, larutan NaCl atau garam dapur memiliki rasa asin sedangkan larutan CH3COOH atau asam cuka memiliki rasa asam.
Sifat-sifat Koligatif Larutan
Berikut beberapa sifat koligatif larutan yang akan dibahas lebih detail.
- Penurunan Tekanan Uap
Suatu zat terlarut yang tidak mudah menguap akan menghasilkan tekanan uap yang lebih rendah dari tekanan uap pelarut murni.
Sifat tekanan uap pelarut volatil di atas larutan yang mengandung non volatil akan berbanding lurus dengan konsentrasi pelarut pada suatu larutan. Hal ini dinyatakan dalam Hukum Raoult.
“tekanan uap dari pelarut di atas larutan sama dengan hasil kali fraksi mol dari pelarut dengan tekanan uap dari pelarut murni”.
Rumus dari hukum tersebut yaitu:
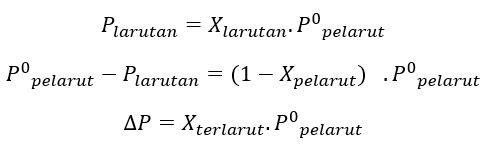
- Kenaikan Titik Didih
Titik didih adalah temperatur ketika tekanan uap suatu larutan sama dengan tekanan eksternalnya.
Adanya zat terlarut pada suatu larutan mengakibatkan adanya kenaikan titik didih dari larutan tersebut.
Sehingga titik didih larutan lebih tinggi dibandingkan dari titik didih pelarut murni. Rumus dari adanya kenaikan titik didih adalah sebagai berikut.
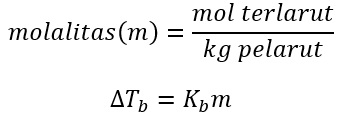
Dengan Kb adalah konstanta kenaikan titik didih dan m adalah molalitas larutan.
- Penurunan Titik Beku
Suatu larutan yang mengandung pelarut volatil dan zat terlarut non volatil akan mengalami penguapan pada partikel pelarutnya saja sehingga hanya tertinggal zat terlarutnya saja.
Titik beku suatu larutan diartikan sebagai temperatur dengan tekanan uap larutan yang sama dengan tekanan uap pelarut murni.
Terjadinya penurunan tekanan uap larutan dari tekanan uap pelarut mengakibatkan larutan membeku pada temperatur yang lebih rendah dibandingkan titik beku pelarut murni.
Rumus dari penurunan titik beku dari sifat koligatif larutan adalah sebagai berikut.
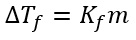
- Tekanan Osmosis
Osmosis adalah peristiwa adanya perpindahan dari partikel pelarut melalui membran semipermeable dari larutan dengan konsentrasi zat yang terlarut lebih rendah menuju larutan yang memiliki konsentrasi zat yang lebih tinggi.
Contoh Soal dan Pembahasan
1. Tekanan osmosis dari larutan Kl dengan konsentrasi 0,01 M adalah 0,465 atm. Maka, hitunglah faktor Hoff pada Kl untuk konsentrasi ini
Jawab:
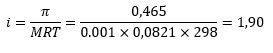
2. Berat massa NaOH yang harus dilarutkan dalam air hingga 100 mL untuk memperoleh normalitas sebesar 0,2 N adalah
Jawab:
Satu molekul NaOH melepas satu ion OH+ sehingga massa ekivalen NaOH adalah 40. Massa ekivalen NaOH sama dengan massa molekul relatif NaOH sehingga
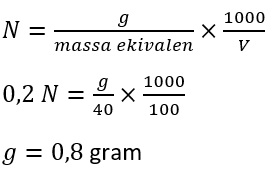
Dengan demikian, massa NaOH yang harus dilarutkan sebesar 0,8 gram.
