Daftar isi
Osmotik didefinisikan sebagai aliran bersih atau pergerakan molekul pelarut melalui membran semipermeabel yang tidak dapat dilewati oleh molekul terlarut.
Jika larutan penyangga terdiri dari molekul terlarut dan pelarut ditempatkan di satu sisi membran dan pelarut murni ditempatkan di sisi lain, ada aliran bersih pelarut ke sisi larutan membran. Tekanan osmotik merupakan faktor penting yang mempengaruhi sel. Berikut ini pembahasan mengenai tekanan osmotik.
Pengertian Tekanan Osmotik
Pengertian Secara Umum
Tekanan osmotik adalah tekanan minimum yang perlu diterapkan pada larutan untuk mencegah aliran masuknya pelarut murni melintasi membran semipermeabel.
Ini juga didefinisikan sebagai ukuran kecenderungan solusi untuk mengambil dalam pelarut murni oleh osmosis.
Tekanan potensial osmotik adalah tekanan osmotik maksimum yang dapat berkembang dalam larutan jika dipisahkan dari pelarut murni oleh membran semipermeabel.
Osmosis terjadi ketika dua larutan, yang mengandung konsentrasi zat terlarut yang berbeda, dipisahkan oleh membran selektif permeabel.
Molekul pelarut melewati secara istimewa melalui membran dari larutan konsentrasi rendah ke larutan dengan konsentrasi zat terlarut lebih tinggi. Transfer molekul pelarut akan berlanjut sampai kesetimbangan tercapai.
Pengertian Menurut Para Ahli
Adapun definisi tekanan osmotik menurut para ahli, antara lain:
- Biology Dictionary
Tekanan osmotik dapat dianggap sebagai tekanan yang diperlukan untuk menghentikan air agar tidak berdifusi melalui penghalang oleh osmosis. Dengan kata lain, ini mengacu pada seberapa keras air akan “mendorong” untuk melewati penghalang agar berdifusi ke sisi lain. Tekanan osmotik ditentukan oleh konsentrasi zat terlarut air akan “berusaha lebih keras” untuk berdifusi ke area dengan konsentrasi zat terlarut yang tinggi, seperti garam, daripada ke area dengan konsentrasi rendah. - Lumen Learning
Tekanan osmotik adalah tekanan yang perlu diterapkan untuk mencegah aliran air ke dalam membran semipermeabel. Tekanan osmotik juga dapat dijelaskan sebagai tekanan yang diperlukan untuk menghentikan osmosis.
Manfaat Tekanan Osmotik
Tekanan osmotik memiliki manfaat yang beragam, diantaranya yaitu:
- Penyerapan dari saluran pencernaan, juga pertukaran cairan di berbagai kompartemen tubuh mengikuti prinsip osmosis.
- Tekanan osmotik protein plasma mengatur air mengalir dari cairan usus bebas protein ke dalam pembuluh darah.
- Sel darah merah yang hidup, jika tersuspensi dalam larutan NaCl 0,92%, tidak mendapat atau kehilangan air. Secara singkat, cairan intraseluler sel darah merah adalah isotonik dengan membran sel darah merah dalam larutan NaCl 0,92%.
- Transportasi air pada tanaman
Aliran osmotik memainkan peran penting dalam pengangkutan air dari sumbernya di tanah ke pelepasannya oleh transpirasi dari daun, dibantu oleh kekuatan ikatan hidrogen antara molekul air. - Proses Cuci Darah (Dialisis)
Prinsip tekanan osmotik dapat diaplikasikan dalam bidang medis yaitu pada proses cuci darah atau yang juga dikenal dengan dialisis. Dalam bidang medis, cuci darah sangat penting bagi pasien penderita gagal ginjal yang diakibatkan oleh disfungsi ginjal sehingga tidak bisa berfungsi dengan semestinya untuk melakukan filtrasi darah. - Untuk pengawetan makanan
Prinsip kerja tekanan osmotik dapat digunakan dalam industri makanan yaitu untuk proses pengawetan makanan. - Pemurnian atau Desalinasi Air Laut
Agar air laut bisa digunakan dan dikonsumsi, maka perlu adanya pemurnian air dari zat terlarut yang ada pada air laut. - Pemurnian air limbah
Bukan hanya untuk memurnikan air laut, prinsip kerja tekanan osmotik juga bisa digunakan sebagai pemurnian air limbah untuk menghilangkan zat zat berbahaya sebelum dibuang ke lingkungan, yaitu melalui pengaplikasian reverse osmosis (RO) atau osmosis balik. Sama halnya ketika akan memurnikan air laut. - Prinsip kerja infus
Prinsip kerja infus pada dasarnya menerapkan tekanan osmotik. Prinsip tekanan osmotik dalam penggunaan infus adalah contoh penerapan sifat larutan koligatif di bidang kesehatan. Penemu prinsip tekanan osmotik sebagai salah satu sifat koligatif larutan adalah Jacobus Henricus van’t Hoff. - Prinsip kerja minuman pengganti ion tubuh
Prinsip tekanan osmotik bukan hanya digunakan pada cairan infus, tapi minuman-minuman pengganti ion tubuh yang kini marak di kalangan masyarakat juga menggunakan prinsip ini sebagai dasar pembuatannya.
Tekanan Osmotik Pada Sel Darah
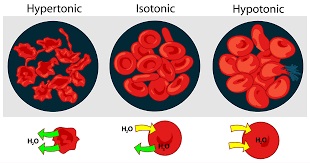
Peristiwa osmosis juga ternyata dapat terjadi dalam sistem biologis manusia tepatnya yaitu dalam sel darah.
Ketika sel darah berada dalam larutan hipotonik (larutan dengan konsentrasi terlalu rendah) maka dinding sel darah akan membiarkan air di luar sel untuk masuk ke dalam sel dan membuat air yang masuk tersebut memberikan tekanan terhadap dinding sel sehingga menjadi mengembang. Kondisi ini disebut sebagai turgid.
Jika sel darah berada pada larutan hipertonik (larutan dengan konsentrasi terlalu tinggi) maka akan membuat air yang berada di dalam sel darah akan keluar melalui membran semipermeabel dinding sel menuju larutan diluar karena konsentrasinya yang lebih tinggi.
Kondisi ini akan menyebabkan sel menjadi mengerut, hal ini disebut sebagai peristiwa krenasi.
Oleh karena itu dengan adanya peristiwa tekanan osmotik ini maka kita tidak disarankan untuk meminum air laut.
Hal itu karena air laut merupakan larutan dengan konsentrasi tinggi dan jika masuk ke dalam tubuh kita akan menyebabkan terjadinya krenasi dalam sel tubuh kita.
Jika krenasi terjadi maka sel akan mati karena hilangnya molekul air dan tentunya berbahaya untuk manusia.
Rumus Tekanan Osmotik
Pehitungan untuk penentuan tekanan osmotik pada dasarnya diturunkan dan didapat dari persamaan hukum gas ideal yang ada dimana tekanan dan volume sebanding dengan jumlah mol, konstanta gas serta suhu.
P V = n R T
Dalam hal ini, kita menggunakan sistem larutan yang diketahui besaran konsentrasinya sehingga kita dapat menggunakan nilai konsentrasi ke dalam persamaan. Konsentrasi merupakan jumlah mol tiap satuan volume.
M = n / V
Jika dimasukkan ke dalam persamaan gas ideal maka akan didapat persamaan berikut.
P = n/V R T
P = M R T
Karena tekanan osmotik dilambangkan dengan , maka kita dapat menuliskan rumus persamaan tekanan osmotik yaitu.
= M x R x T
Atau untuk larutan elektrolit yaitu.
= M x R x T x i
Dalam hal ini, i merupakan faktor Van’t Hoff yang dimiliki oleh suatu larutan elektrolit. Faktor Van’t Hoff dapat dirumuskan sebagai berikut.
i = 1 + (n-1)
dimana n adalah jumlah ion positif (kation) dan ion negatif (anion) dalam larutan sedangkan adalah derajat ionisasi larutan.
Contoh Soal Tekanan Osmotik


