Daftar isi
Senyawa kimia memiliki peranan besar dalam kehidupan sehari-hari. Sehingga senyawa kimia tidak bisa dilepaskan dari berbagai proses dalam keseharian. Senyawa kimia tidak hanya terdapat dalam makanan atau bahan-bahan lain yang kita gunakan, melainkan tubuh manusia pun terdiri dari susunan senyawa kimia, yang disebut senyawa organik.
Senyawa organik sebagian besar disusun dari unsur karbon. Oleh karena itu, senyawa organik lebih dikenal dengan sebutan senyawa karbon.
Berikut ini penjelasan lengkap tentang senyawa karbon:
Pengertian Senyawa Karbon
Senyawa karbon merupakan salah satu unsur kimia yang memiliki keunikan. Komponen utama dari senyawa karbon yaitu tersusun dari atom karbon (C), hidrogen (H), oksigen (O), nitrogen (N), sulfur (S), serta unsur-unsur organik lain. Karbon diketahui sebagai komponen terbesar dalam senyawa kimia yang ada di bumi.
Senyawa karbon memiliki keunikan yaitu elektron valensi atom karbon berjumlah 4. Hal ini memungkinkan karbon dapat dapat mengikat 4 atom atau bisa jadi lebih. Karbon dapat membentuk ikatan tunggal, rangkap dua, serta rangkap tiga. Dengan demikian, atom karbon bisa membentuk rantai karbon mengikat gugus fungsi yang beragam. Hal ini yang membuat cakupan senyawa karbon sangat luas.
Ciri-Ciri Senyawa Karbon
Senyawa karbon atau senyawa organik memiliki ciri-ciri sebagai berikut:
- Titik leleh dan titik didihnya relatif rendah
- Bersifat non-polar, menjadikan kelarutannya rendah di dalam air dan tinggi di pelarut non-polar
- Mudah terbakar
- Tidak dapat menghantarkan listrik
- Dalam proses reaksi kimianya berlangsung relatif lambat
- Memiliki isomer. Isomer adalah senyawa yang memiliki rumus molekul sama tetapi strukturnya berbeda
- Jenis ikatan kimianya sebagian besar merupakan ikatan kovalen
Penggolongan Senyawa Karbon
Cakupan senyawa karbon sangat luas, sebab kemampuan yang dimiliki atom karbon yaitu dapat membentuk rantai karbon dan mengikat gugus fungsi yang beragam. Berdasarkan pada gugus fungsi yang dimilikinya, senyawa karbon digolongkan menjadi 7 jenis, yaitu Alkohol, Eter, Aldehid, Keton, Asam Karboksilat, Ester, dan Alkil Halida.
Di bawah ini merupakan tabel penggolongan senyawa karbon berdasarkan gugus fungsinya:
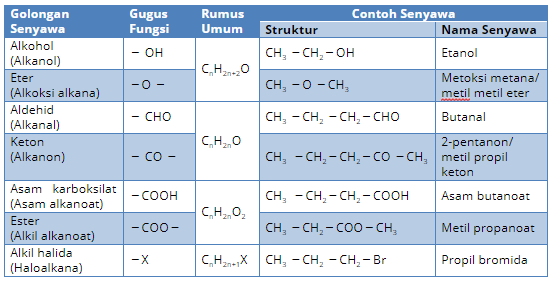
Penjelasan singkatnya, golongan senyawa dengan rumus molekul yang sama, tetapi fungsinya berbeda selalu memiliki selisih satu atom hidrogen.
- Alkohol (- OH) dan Eter (-O-)
- Aldehid (- CHO) dan Keton (-CO-)
- Asam alkanoat (-COOH) dan Ester (-COO-)
Golongan Senyawa Karbon dan Karakteristiknya
1. Alkohol (Alkanol)
a. Pengertian dan Penggolongan Alkohol
Alkohol adalah senyawa karbon dengan gugus fungsi -OH (gugus hidroksi) yang rumus umumnya yaitu R- OH. Alkohol mudah larut dalam air dan memiliki titik didih relatif tinggi. Hal ini dikarenakan adanya ikatan hidrogen.
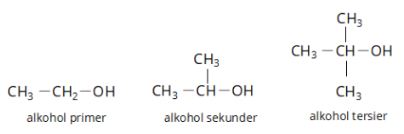
Berdasarkan letak dari gugus hidroksinya, alkohol dibagi menjadi tiga jenis, yaitu:
- Alkohol primer
- Alkohol sekunder
- Alkohol tersier
Berikut ini gambar ketiga jenis alkohol dari perbedaan gugus fungsinya:
b. Tata Nama Senyawa Alkohol
IUPAC menjelaskan bahwa tata nama alkohol ialah sebagai berikut:
- Rantai terpanjang yang menjadi nama alkoholnya harus mengikat gugus fungsi -OH.
- Penomoran pada atom karbon dimulai dari yang paling dekat dengan atom karbon pengikat gugus fungsi -OH.
- Apabila terdapat lebih dari satu gugus hidroksil, maka digunakan penandaan “di”, “tri”, dan seterusnya kemudian diakhiri akhiran -ol.
c. Reaksi pada Alkohol
Supaya lebih memudahkan, berikut ini tabel penjelasan jenis reaksi pada alkohol:

2. Eter (Alkohol Alkana)
a. Pengertian Eter
Eter merupakan senyawa karbon yang memiliki rumus molekul R-O-R’, dengan R dan R’ adalah gugus alkil, baik alkil yang sejenis maupun tidak sejenis. Pada molekul eter, atom oksigen bertindak sebagai gugus fungsi.
Eter tidak mudah larut dalam air, sebab memiliki sifat yang nonpolar. Sifat dari eter mudah terbakar dengan titik didih yang relatif rendah.
b. Tata Nama Eter
Penjelasan dari IUPAC, tata nama eter adalah sebagai berikut:
- Rantai karbon paling pendek yang mengikat gugus fungsi -OH- ditetapkan sebagai gugus fungsi alkoksinya
- Rantai karbon yang lebih panjang diberi nama sesuai dengan senyawa alkananya. Bagi nama trivial, penamaan eter dilakukan dengan menyebutkan nama kedua gugus alkil yang mengapit gugus -OH, dan diberi akhiran eter.
c. Reaksi pada Eter
Berikut ini tabel penjelasan reaksi pada eter:

3. Aldehid (Alkanal)
a. Pengertian Aldehid
Aldehid merupakan senyawa karbon dengan rumus molekul R – COH yang mengandung gugus karbonil. Gugus karbonil adalah suatu gugus fungsi yang terdiri dari sebuah atom karbon dan atom oksigen yang memiliki ikatan rangkap.
Aldehid bersifat polar, sehingga bisa larut dalam air. Aldehid dapat dioksidasi oleh pereaksi Fehling dan Tollens. Apabila Aldehid dioksidasi dengan pereaksi Fehling, maka akan menghasilkan endapan bata merah. Sedangkan yang menggunakan pereaksi Tollens akan menghasilkan cermin perak.
b. Tata Nama Aldehid
Tata nama aldehid menurut IUPAC adalah sebagai berikut:
- Rantai terpanjang yang menjadi nama alkanalnya harus mengikat gugus – CHO
- Penomoran atom karbon dimulai dari atom karbon pengikat gugus – CHO
4. Keton
a. Pengertian Keton
Keton adalah senyawa karbon yang memiliki rumus umum R-CO-R’. Nama lain keton yaitu senyawa karbonil karena memiliki gugus fungsi C= O.
Keton dapat dibuat dari oksidasi alkohol sekunder. Perbedaan keton dengan aldehid ialah keton tidak bisa dioksidasi oleh pereaksi Fehling dan Tollens.
b. Tata Nama Keton
Tata nama keton menurut IUPAC sebagai berikut:
- Rantai karbon terpanjang yang menjadi nama alkanol harus mencakup gugus fungsi -CO-
- Atom C gugus karbonil harus memiliki nomor serendah mungkin, dan untuk nama trivial keton kedua gugus alkil yang terikat pada gugus karbonil disebutkan paling dulu berdasarkan alfabet, lalu diikuti dengan kata keton
5. Asam Karboksilat
a. Pengertian Asam Karboksilat
Asam karboksilat merupakan senyawa karbon yang memiliki rumus umum R – COOH (gugus karboksil). Gugus karboksil pada asam karboksilat adalah gabungan dari gugus karbonil dan gugus hidroksil.
Oksidasi kuat alkohol primer dapat membentuk asam karboksilat ini. Asam karboksilat dapat larut dalam air karena bersifat polar.
b. Tata Nama Asam Karboksilat
Berikut ini tata nama asam karboksilat menurut IUPAC:
- Pada rantai karbon terpanjang pengikat gugus karboksil akhiran -ana diganti dengan akhiran -anoat
- Pada nama alkanoatnya diberi awalan asam
c. Reaksi pada Asam Karboksilat
Tabel di bawah ini menjelaskan tentang reaksi pada asam karboksilat:

6. Ester
a. Pengertian Ester
Ester adalah senyawa karbon yang memiliki rumus umum R – COO – R’. Ester bisa dihasilkan dari proses reaksi alkohol dengan asam karboksilat. Reaksi pembentukan ester tersebut disebut reaksi esterifikasi, mengikuti persamaan ini:
R – COOH – R’ – OH → R – COO -R’ + H2O
b. Tata Nama Ester
Tata nama atau penamaan ester menurut IUPAC yaitu dengan cafa menyebutkan gugus alkalinya terlebih dahulu, lalu diikuti dengan gugus alkanoat.
c. Reaksi pada Ester
Reaksi trigliserida basa yang menghasilkan sabun (garam alkanoat) dan gliserol merupakan satu reaksi substitusi penting pada ester. Sebutan dari reaksi itu adalah reaksi penyabunan atau saponifikasi dengan mengikuti persamaan berikut:
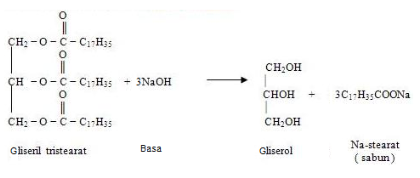
Berikut ini tabel yang menjelaskan reaksi pada ester:

7. Alkil Halida (Haloalkana)
a. Pengertian Alkil Halida
Alkil halida merupakan senyawa turunan yang dihasilkan dari alkana yang terbentuk dari proses reaksi substitusi atom hidrogen oleh unsur yang berasal dari golongan halogen (golongan VII A). Alkil halida memiliki rumus umum R – X, dimana X adalah halogen (F, Cl, Br, I).
b. Tata Nama Alkil Halida
Penamaan atau tata nama pada alkil halida menurut IUPAC adalah seperti berikut:
- Rantai terpanjang dengan gugus X dipilih sebagai rantai utama, dan nomor gugus X dibuat serendah mungkin
- Apabila terdapat lebih dari satu unsur atom halogen, urutan penomorannya didasarkan pada tingkat kereaktifan halogen, sementara penamaannya berdasarkan pada urutan abjad
- Apabila jumlah atom sejenis lebih dari satu, maka digunakan awalan “di”, “tri”, dan seterusnya
Isomer pada Senyawa Karbon
Isomer adalah senyawa yang memiliki rumus molekul atau atom penyusun sama, tetapi strukturnya berbeda. Keisomeran yang terjadi pada senyawa karbon yaitu isomer struktur dan isomer ruang.
1. Isomer Struktur
Isomer struktur bisa berupa:
- Isomer Rangka, yaitu dua senyawa yang memiliki rumus molekul sama, tetapi berbeda rantai utamanya. Contohnya n-butana dengan 2-metil propana
- Isomer Posisi, adalah dua senyawa yang rumus molekulnya sama, namun posisi gugus fungsinya berbeda. Contohnya 1-propanol dengan 2-propanol
- Isomer Fungsi, yaitu isomer dengan rumus molekul sama, tapi gugus fungsinya berbeda. Contohnya seperti propanal dengan propanon (aldehid dan keton)
2. Isomer Ruang
Sedangkan untuk isomer ruang bisa berupa:
- Isomer Geometri, yaitu isomer yang terjadi pada senyawa yang memiliki bagian molekul tetap, misalnya ikatan rangkap atau cincin
Bentuk isomer geometri ada dua, yaitu senyawa cis yang terbentuk ketika gugus yang sejenis berada pada satu sisi. Contohnya cis – dikloroetena.
Sedangkan bentuk yang kedua ialah senyawa trans yang terbentuk ketika gugus sejenis berada pada sisi yang berseberangan. Contohnya trans – dikloroetena.
- Isomer Optik, adalah isomer yang terjadi pada senyawa dengan atom karbon asimetris atau atom karbon kiral (C kiral), yaitu atom karbon yang mengikat 4 gugus atau unsur yang berbeda
Senyawa dengan isomer optik disebut senyawa optis aktif, memiliki ciri dapat memutar bidang polarisasi. Contohnya asam amino alanin yang memiliki rumus molekul CH(NH2)(COO)(CH3).
Reaksi Senyawa Karbon
Reaksi-reaksi umum yang terjadi pada senyawa karbon dijelaskan pada tabel yang ada di bawah ini:
Contoh Soal Senyawa Karbon
Agar lebih dapat dipahami, di bawah ini merupakan contoh soal dari pembahasan senyawa karbon:
Jumlah maksimum isomer optik yang bisa dimiliki oleh suatu senyawa dapat ditentukan berdasarkan jumlah atom C asimetris atau C kiral yang dimiliki. Jumlah maksimum isomer optik = 2n dengan n adalah jumlah atom C kiral.
Apabila jumlah maksimum isomer optik untuk senyawa 2-metil-2,4-dihidroksi pentana dan 2,4-dihidroksi pentana dinyatakan sebagai p dan q berturut-turut, manakah pernyataan yang tepat dari pilihan di bawah ini?
A. p = q
B. p > q
C. p < q
D. p = 2q
E. p = 4q
Jawaban: C
Demikian pembahasan dan penjelasan singkat tentang senyawa karbon. Untuk mendalami peranan senyawa karbon pada cakupan yang luas Diperlukan pembahasan atau pembelajaran yang lebih mendalam lagi. Artikel ini hanya memberikan penjelasan dasar atau garis besar yang memberikan gambaran tentang senyawa karbon. Diharapkan setelah membaca artikel ini akan jadi lebih mengetahui tentang berbagai hal dasar dari senyawa karbon.
