Daftar isi
Pernah mendengar benzena? Apa itu benzena? Berikut ini pembahasannya.
Pengertian Benzena
Benzena adalah senyawa kimia organik yang tersusun dengan rumus molekul C6H6 dan merupakan senyawa kimia organik yang berbentuk cairan tak berwarna dan dapat sangat mudah terbakar.
Benzena juga memiliki aroma yang manis, jangan sampai tertipu.
Molekul benzena terdiri dari enam atom karbon yang disatukan dalam sebuah cincin dengan satu atom hidrogen yang terikat pada masing-masingnya.
Karena hanya mengandung atom karbon dan hidrogen, benzena digolongkan sebagai hidrokarbon.
Sejarah Penemuan Benzena
Friedrich August Kekul adalah seorang kimiawan asal Jerman. Dialah pendiri pertama teori struktur kimia dan khususnya struktur Kekule dari benzena.
Karya Kekule yang paling terkenal adalah pada struktur benzena. Pada tahun 1865 Kekulé menerbitkan sebuah tulisan berbahasa Prancis yang isinya menyebutkan bahwa menyarankan struktur kimia haruslah mengandung cincin atom karbon beranggota enam dengan ikatan bergantian tunggal dan ganda.
Formula untuk benzena telah lama dikenal, tetapi strukturnya yang sangat tidak jenuh belum ditemukan.
Archibald Scott Couper pada tahun 1858 dan Joseph Loschmidt pada tahun 1861 melakukan penelitian kemungkinan adanya struktur yang mengandung banyak ikatan rangkap atau cincin ganda, akan tetapi studi tentang senyawa aromatik awal, masih terlalu sedikit bukti yang tersedia untuk membantu ahli kimia menentukan struktur tertentu.
Pada akhirnya lebih banyak bukti yang tditemukan pada tahun 1865, terutama mengenai hubungan isomer aromatik.
Kekule berpendapat untuk struktur kimia yang dengan mempertimbangkan jumlah isomer yang diamati untuk turunan dari benzena.
Senyawa Turunan Benzena dan Tata Namanya
Senyawa turunan benzena berasal dari benzena yang mana satu atau lebih atom H-nya diganti dengan substituen lain berupa atom seperti −Br ataupun gugus atom seperti −COOH. Satu atom H pada benzena diganti satu substituen.
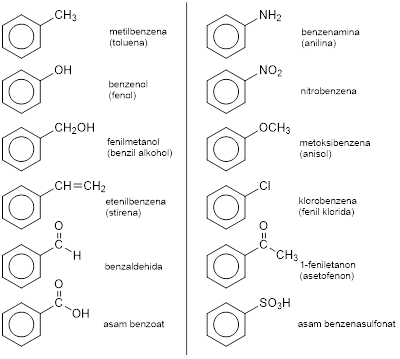
−COOH, −SO3H, −COOR, −CN, −CHO, −CO, −OH, −NH2, −OR, −R, −X (F, Cl, Br, I), −NO2 Bila terdapat lebih dari satu substituen, maka diberi penomoran searah atau berlawanan arah agar substituen-substituen mendapat nomor serendah mungkin.
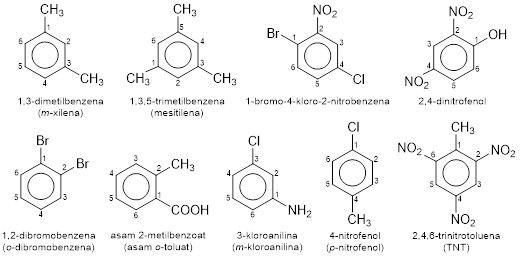
Untuk substituen-substituen sejenis, digunakan awalan di-, tri-, tetra-, penta-, dan heksa-.
Bila terdapat dua substituen, selain dengan penomoran, juga dapat digunakan awalan o-(orto) untuk posisi atom karbon nomor 1 dan 2, m-(meta) untuk posisi 1 dan 3, atau p-(para) untuk posisi 1 dan 4.
Bila cincin benzena sebagai substituen, bukan sebagai induk, maka gugus benzena yang kehilangan satu atom H (C6H5−) disebut gugus fenil dan gugus metilbenzena (toluena) yang kehilangan satu atom H (C6H5CH2−) disebut gugus benzil.
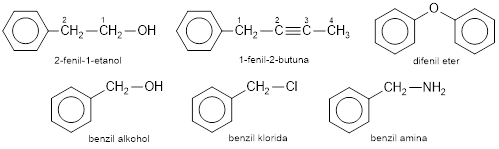
Sifat-sifat benzena
Secara umum, sifat senyawa dibedakan menjadi dua, sifat fisik dan sifat kimia.
Sifat Fisik
Benzena, zat cair tidak berwarna, mudah menguap, dan sangat beracun. Benzena dipakai sebagai pelarut, pensintesis untuk berbagai senyawa karbon, dan bahan dasar pembuatan senyawa karbon.
Benzena tidak begitu reaktif, tapi sangat mudah terbakar, karena kadar karbon yang terkandung sangat tinggi.
Turunan dari benzena bersifat polar dan non polar. Senyawa polar yaitu suatu senyawa yang terbentuk akibat adanya suatu ikatan antar elektron pada unsur-unsurnya.
Titik didih pada benzena dan turunannya dimulai dari 80-250 derjat celsius. Untuk titik lelehnya bervariasi, dengan angka tertinggi yaitu 122 derjat celsius pada senyawa asam benzoat (-COOH).
Variasi titik didih tersebut karena perngaruh dari kepolaran gugus fungsionalnya.
Begitu juga dengan titik lelehnya, dipengaruhi oleh subtitutenya.
Toluena, dan etil benzena bersifat non-polar. Sedangkan anilin, benzil alkoho, fenol, dan asam benzoat bersifat polar.
Maka bisa disimpulkan asam benzoat mempunyai titik didih tertinggi karena sifat polarnya sedangkan benzena memiliki titik didih terendah.
Sifat Kimia
Derajat keasaman merupakan sifat kimia benzena dan turunannya. Fenol dan asam benzoat termasuk asam lemah.
Asam benzoat lebih kuat dibandingkan fenol.
Fenol yang mempunyai gugus fungsi -OH bersifat asam lemah, yang berarti memberikan ion H+, sedangkan anilin yang memiliki gugus –NH2 bersifat basa lemah, yang berarti menerima ion H+.
Benzena lebih mudah mengalami reaksi subtitusi daripada reaksi adisi.
Fungsi Benzena dalam Kehidupan Sehari-hari
- Karbol yang merupakan desinfektan untuk kamar mandi dan lantai.
- Asam benzoat, nipagin, dan nipasol yang sering digunakan sebagai pengawet makanan dan minuman.
- Asam salisilat ditambahkan ke dalam bedak dan salep sebagai zat antifungi (anti jamur).
- Aspirin digunakan sebagai zat analgesik atau penghilang rasa sakit dan zat antipiretik (penurun panas).
- Parasetamol dikenal juga dengan asetaminofen. Obat ini memiliki khasiat yang sama seoerti aspirin, namun lebih aman di lambung.
- Benzil alkohol digunakan sebagai zat antiseptik dalam obat kumur untuk mengurangi bau mulut.
- Zat warna azo merupakan pewarna sinetik yang dikelompokkan menjadi dua jenis, yaitu Pewarna tekstil dan Pewarna makanan,
- TNT (2,4,6-trinitrotoluena) merupakan senyawa turunan benzana yang banyak digunakan sebagai bahan peledak.
Struktur Benzena
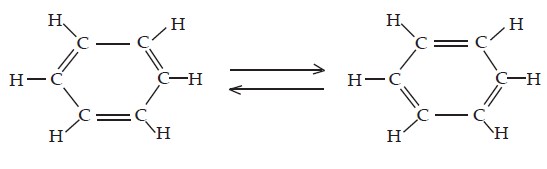
Pada tahun 1872 Friedrich August Kekule mengusulkan bahwa benzena mengandung tiga ikatan tunggal dan tiga ikatan rangkap yang berselang-seling.
Reaksi Benzena
1. Reaksi halogenasi
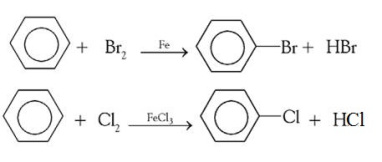
- Benzena bereaksi dengan atom halogen (gologan VIIA)
- Menggunakan katalis FeCl3 atau FeBr3, maupun katalis yang mengandung besi (Fe)
- Menghasilkan halobenzena (benzena yang memiliki gugus halogen) dan asam kuat
2. Reaksi nitrasi
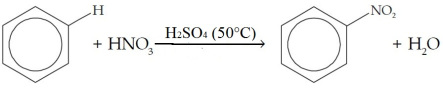
- Benzena bereaksi dengan asam nitrat (HNO3 atau HONO2)
- Reaksi nitrasi memerlukan katalis asam sulfat (H2SO4) pekat
- Hasil reaksi (produk) berupa nitrobenzena dan air
- Reaksi berlangsung pada suhu 50°C
3. Reaksi Sulfonasi
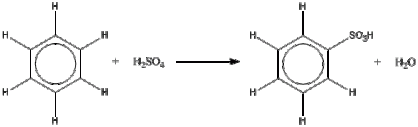
- Reaksi sulfonasi berasal dari pencampuran benzena terhadap ion sulfat (sulfonasi)
- Benzena bereaksi dengan asam sulfat (H2SO4)
- Reaksi ini tidak memerlukan katalis karena benzena dipanaskan, jadi suhu meningkat sehingga laju reaksi pun juga meningkat
- Hasil reaksi berupa asam benzenasulfonat dan air
4. Reaksi alkilasi
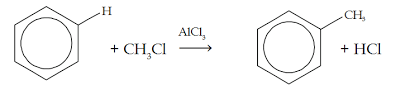
- Benzena bereaksi dengan haloalkana (ex = C2H5Br)
- Menggunakan katalis AlCl3, inilah yang membedakannya dengan reaksi halogenasi
- Menghasilkan halobenzena dan asam kuat.
5. Reaksi asilasi
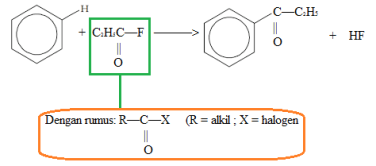
- Reaksi benzena dengan mensubstitusi atom H oleh gugus asil
- Gugus asil adalah gugus yang diturunkan dari asam benzoat (—COOH) dengan menghilangkan gugus hidroksil-nya (—OH) dan diberi nama akhiran -oil
- Menggunakan katalis AlCl3
- Hasil akhir (produk) berupa benzena dengan gugus keton yang berikatan dengan gugus metil
Proses Pembuatan Benzena
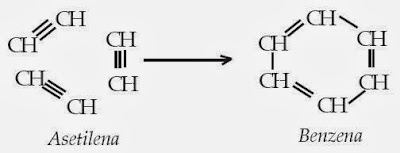
- Polimerisasi asetilena, yaitu dengan mengalirkan asetilena melalui pipa kaca yang pijar. 3C2H2 → C6H6
- Memanaskan kalsium benzoat dengan kalsium hidroksida. Ca(C6H5COO)2 + Ca2(OH) → 2C6H6 + 2CaCO3
- Dengan destilasi bertingkat tir batu bara.
- Dengan proses reforming nafta pada industri petrokimia.
Resonansi Benzena
Resonansi terjadi karena adanya delokalisasi elektron dari ikatan rangkap ke ikatan tunggal.
Hal yang harus diperhatikan adalah, bahwa lambang resonasi bukan struktur nyata dari suatu senyawa, tetapi merupakan struktur khayalan.
Sedangkan struktur nyatanya merupakan gabungan dari semua struktur resonansinya.
Hal ini pun berlaku dalam struktur resonansi benzena, Teori resonansi dapat menerangkan mengapa benzena sukar diadisi.
Sebab, ikatan rangkap dua karbon-karbon dalam benzena terdelokalisasi dan membentuk semacam cincin yang kokoh terhadap serangan kimia, sehingga tidak mudah diganggu.
Oleh karena itulah reaksi yang umum pada benzena adalah reaksi substitusi terhadap atom H tanpa mengganggu cincin karbonnya.
Bahaya Benzena
- Fenol dapat merusak jaringan protein dalam tubuh.
- Azam benzoat tidak boleh digunakan secara berlebihan dapat menyebabkan hiperaktifpada anak dan alergi untuk beberapa orang.
- Asam silsilat sebagai pengawet dapat menimbulkan iritasi dan sakit lambung.
- Asetosol dalam jangka waktu yang lama menyebabkan lapisan mukosa lambung iritasi sehingga menimbulkan sakit magh.
- Parasetamol yang berlebihan dapat menimbulkan gangguan pada ginjal dan hati.
- Zat Pewarna Azo penggunaannya digunakan secara berlebihan, pewarna makanan berpotensi sebagai senyawa karsinogenik.
- Penggunaan TNT secara tidak bertanggung jawab dapat menimbulkan tragedi kemanusiaan.
Contoh Soal dan Pembahasan
Soal 1
Di bawah ini tertera rumus bangun suatu senyawa turunan benzena. Nama senyawa itu adalah…
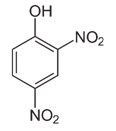
a. 1-hidroksi-2,4-dinitrofenol
b. 1,3-dinitrofenol
c. 2,4-dinitrobenzena
d. 2,4-dinitrofenol
e. 2,4-dinitrotoluena
Jawaban :
Perhatikan deret perioritas, penomoran diberikan bagi yang memiliki perioritas paling tinggi. Yaitu:
COOH>SO3H>CHO>OH>NH2>R>NO2>X.
Jadi pada soal, penomoran 1 diletakkan pada OH karena OH lebih perioritas dari pada NO2. NO2 berada pada penomoran 2 dan 4, karena ada 2 NO2 maka ditambahkan awalan “di”. Jadi nama senyawa tersebut adalah 2,4-dinitrofenol.
Soal 2
Fenol dalam karbol atau lisol berfungsi untuk…
a. Menggantikan kaporit
b. Menjernihkan air
c. Mengharumkan kamar mandi
d. Membunuh kuman
e. Mengilapkan lantai
Jawaban :
Dalam kehidupan sehari-hari, fenol digunakan untuk membuat karbol, suatu desinfektan untuk kamar mandi dan lantai.