Daftar isi
Jika pernah belajar kimia, pasti sering mendengar yang namanya ikatan kovalen. Karena ikatan kovalen merupakan ikatan dari dua atau lebih atom berdasarkan pemakaian elektron secara bersama-sama. Ikatan ini sebenarnya biasanya terjadi antara atom-atom non-logam.
Menurut penelitian yang dilakukan para ahli dalam bidang kimia, menyatakan bahwa ikatan kovalen merupakan sebuah ikatan yang paling kuat dan stabil diantara atom-atom. Dimana ikatan kovalen bisa terjadi diantara atom-atom yang akan menyusun suatu molekul.
Pengertian Ikatan Kovalen
Ikatan kovalen adalah sebuah ikatan yang terbuat dari adanya pemakaian bersama pasangan elektron oleh atom-atom antar sesama unsur non-logam yang saling berikatan. Ikatan ini juga terjadi karena ketidakmampuan salah satu dari atom yang akan berikatan untuk melepas elektron menjadi ion positif.
Khususnya terjadi pada atom non-logam yang memiliki kecenderungan untuk menerima elektron. Atom-atom ini yang terlibat dalam ikatan kovalen adalah atom-atom non-logam. Sehingga ikatan kovalen mempunyai sifat-sifat sebagai berikut:
- Sebagian besar ikatan kovalen mudah untuk menguap.
- Ikatan kovalen mempunyai titik leleh dan didih yang rendah.
- Ikatan kovalen tidak mudah larut dalam air, tetapi bisa larut dalam larutan organik.
- Ikatan kovalen tidak menghantarkan listrik
- Ikatan kovalen berbentuk gas, cairan dan/atau padatan lunak pada suhu ruang.
- Keadaan ikatan kovalen murni bersifat isolator.
Ikatan kovalen selain mempunyai sifat-sifat, tetapi dia juga punya syarat untuk terjadinya ikatan kovalen tersebut, sebagai berikut:
- Bisa terjadi antar unsur-unsur non-logam.
- Bisa terjadi jika terjadi perbedaan dalam keelektronegatifan antara unsur-unsur yang berikatan kecil.
Jenis-Jenis Ikatan Kovalen dan Contohnya Beserta Gambar
Jeniss-jenis kovalen terbagi atas tiga yaitu berdasarkan pembentukannya, polaris, dan Berdasarkan sumber elektron yang akan dipakai bersama. Berikut adalah jenis-jenis ikatan kovalen dan contohnya :
Berdasarkan Pembentukannya
- Ikatan Kovalen Tunggal
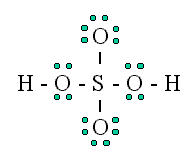
Ikatan kovalen yang pertama adalah tunggal. Dimana ikatan ini bisa terbentuk karena adanya penggunaan bersama satu pasang elektron (setiap atom biasanya memberikan satu elektron valensi untuk digunakan bersama). Jadi dapat dikatakan bahwa jumlahnya adalah PEI=1.
Contoh nya adalah Hidrogen fluorida (HF), Hidrogen 2 mol (H2), dan Air (H20) (konfigurasi elektron H=1, O=2, 6).
Gambar ikatan kovalen tunggal adalah sebagai berikut:
- Ikatan Kovalen Rangkap Dua
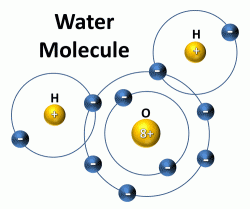
Ikatan kovalen kedua selanjutnya adalah rangkap dua. Artinya adalah ikatan yang dibentuk karena adanya penggunaan bersama dua pasang elektron (setiap elektron biasanya diberikan dua elektron valensi untuk bisa digunakan secara bersama). Jadi dengan kata lain jumlahnya adalah PEI=2.
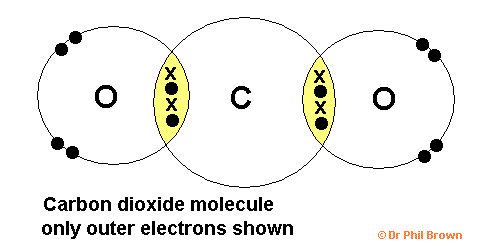
Contohnya adalah Oksigen (O2) dan Karbondioksida (CO2) (konfigurasi elektron O=2, 6; C=2, 4).
Gambar ikatan kovalen rangkap dua adalah sebagai berikut:
- Ikatan Kovalen Rangkap Tiga
Ikatan kovalen ketiga berikutnya adalah rangkap tiga, yang memiliki arti sebagai berikut yaitu ikatan yang dibentuk dari penggunaan secara bersama tiga pasang elektron (setiap elektron biasanya memberikan tiga elektron valensi untuk bisa digunakan secara bersama). Jadi dengan kata lain jumlahnya adalah PEI=3.
Contohnya adalah nitrogen (N2) (konfigurasi elektron N=2, 5).
Gambar dari ikatan kovalen rangkap tiga, yaitu:
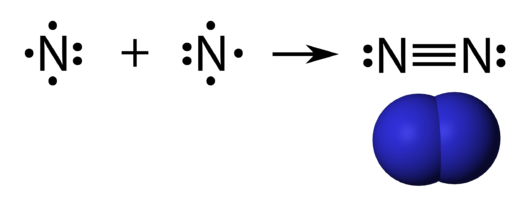
Berdasarkan Polaris
- Ikatan Kovalen Polar
Ikatan keempat selanjutnya adalah ikatan kovalen polar. Artinya adalah ikatan dari PEI nya cenderung untuk mengarah ke salah satu atom yang berikatan. Pemisahan atau kepolaran pada ikatan kovalen ditentukan oleh keelektronegatifan suatu unsur. Dimana kepolaran senyawa kovalen terjadi diantara para atom-atom unsur yang beda keelektronegatifannya besar.
Serta memiliki suatu bentuk yang asimetris dan memiliki momen dipol. Ikatan kovalen tersebut biasanya terjadi diantara dua atom yang saling berbeda yang juga disebut sebagai ikatan kovalen polar. Ikatan kovalen polar juga bisa terjadi diantara dua atom yang mempunyai keelektronegatifan yang berbeda.
Contoh dari ikatan kovalen polar adalah Hidrogen fluorida (HF) dan asam klorida (HCl).
Berikut ini adalah gambar dari ikatan kovalen polar, yaitu sebagai berikut:
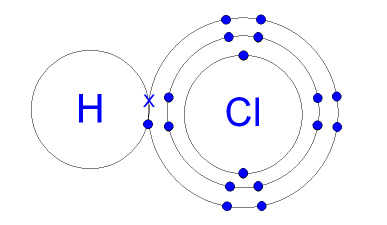
Penjelasannya:
Dalam senyawa HF ini, F nya memiliki keelektronegatifan yang sangat tinggi jika dibandingkan dengan H. Sehingga pasangan elektron tersebut lebih tertarik mengarah ke F, yang mengakibatkan terbentuknya dipol-pol atau pengkutuban (terbentuk kutub-kutub antara H dan F).
- Ikatan Kovalen Nonpolar
Ikatan kovalen kelima adalah ikatan kovalen non polar. Artinya ikatan ini mempunyai PEI yang menarik sama kuatnya untuk mengarah ke arah atom-atom yang saling berikatan. Dimana senyawa kovalen Non polar ini bisa dibentuk karena atom-atom unsur memiliki keelektronegatifan nol yang berbeda atau juga bisa diartikan karena memiliki momen dipol=0 (nol) dan/atau memiliki bentuk molekul yang simetri.
Titik muatan ini juga negatif elektron persekutuan yang saling berhimpit, sehingga pada molekul pembentuknya tidak terjadinya momen dipol. Jadi dapat dikatakan bahwa elektron persekutuan mendapat gaya tarik yang sama kuat.
Contohnya adalah hidrogen (H2).
Berdasarkan sumber elektron yang akan dipakai bersama
- Ikatan Kovalen Murni
Ikatan kovalen keenam selanjutnya adalah ikatan kovalen murni, yang berarti kovalen ini mempunyai sepasang atau lebih ikatan yang betul-betul akan dipakai dari masing-masing unsur yang menyumbang untuk dipakai secara bersama.
Contoh ikatan kovalen murni adalah gas hidrogen 2 mol (H2).
- Ikatan Kovalen Koordinasi
Ikatan kovalen yang terakhir adalah koordinasi yang memiliki pengertian sebagai berikut yaitu pasangan elektron yang digunakan bersama hanya disumbangkan oleh satu atom saja, sedangkan atom yang satunya tidak menyumbangkan elektron.
Jadi ikatan ini hanya memiliki satu atom pemberi pasangan elektron bebas saja, sedangkan atom yang satunya lagi hanya sebagai penerima saja. Ikatan ini biasanya kadang-kadang dinyatakan dalam tanda panah saja (->) yang berguna untuk menunjukkan arah donasi dari pasangan elektron.
Contohnya adalah BF3NH3 molekul HNO3, SO3, NH4Cl, dan H2SO4.
Gambar dari ikatan kovalen koordinasi adalah
5B = 1s2 2s2 2p1
9F = 1s2 2s2 2p5
7N = 1s2 2s2 2p3