Daftar isi
Tahukah kamu? Kata atom berasal dari bahasa Yunani yaitu atomos yang berarti tidak dapat dibagi.
Konsep dasar atom pertama kali dikemukakan oleh Democritus pada awal abad ke-4 Sebelum Masehi. Lalu apakah pernyataan ini sepenuhnya benar? Mari kita simak penjelasannya.
Pengertian Teori Atom
Teori Atom adalah suatu benda dapat dibagi menjadi bagian-bagian yang sangat kecil yang akhirnya tidak dapat dibagi lagi.
Menurut Democritus, atom sepenuhnya padat, tidak memiliki struktur internal, serta ada ruang kosong antar atom untuk memberikan ruang untuk pergerakannya.
Selain itu, Democritus juga menjelaskan bahwa untuk menjelaskan perbedaan sifat dari material yang berbeda, atom dibedakan ke dalam bentuk, massa dan ukurannya.
Berdasarkan model atom yang dibuatnya, Democritus mampu menjelaskan bahwa semua benda terdiri dari bagian yang lebih kecil disebut atom.
Namun model Democritus ini kurang memiliki bukti eksperimental hingga mulai tahun 1800-an muncul teori-teori baru berdasarkan hasil eksperimen.
Sejarah Penemuan Atom
Teori mengenai atom ini pertama kali dijelaskan dalam sebuah naskah filsafat janisme.
Kemudian satu abad sesudahnya, seseorang bernama Demokritus menciptakan sebuah istilah yang dinamakan atomos yang berarti tidak dapat terbagi-bagi.
Lambat laun seiring dengan kemajuan ilmu pengetahuan, istilah atom dari pendapat demokritos menjadi istilah umum dalam ilmu pengetahuan mengenai atom.
Seiring dengan perkembangan ilmu kimia, seorang ilmuwan bernama Robert Boyle kemudian mencetuskan sebuah argumen atau pendapat dalam bukunya yang berjudul The Sceptical Chymist.
Dimana ia menjelaskan bahwa dunia ini terdiri dari berbagai kombinasi yaitu atom-atom yang berbeda.
Hal ini berbeda dengan dengan pendapat-pendapat klasik yang menjelaskan bahwa materi-materi hanya terdiri empat elemen yaitu air, api, tanah dan angin.
Hingga pada tahun 1789, seorang ilmuwan bernama Antoine Lavoisier mendefinisikan bahwa elemen merupakan suatu bahan dasar yang sudah tidak dapat dibagi-bagi lagi dengan menggunakan metode-metode kimia.
Siapa penemu atom modern?

Hingga pada tahun 1803, seorang ilmuwan yang juga ahli kimia bernama John Dalton dalam bukunya yang berjudul New System of Chemical Philosophy berhasil mencetuskan sebuah teori mengenai atom, dimana teorinya ini berdasarkan hasil eksperimen yang ia lakukan.
Ia menyatakan bahwa materi terdiri atas atom yang tidak dapat dibagi lagi. Tiap-tiap unsur terdiri atas atom-atom dengan sifat dan massa identik.
Dan senyawa terbentuk jika atom dari berbagai unsur bergabung dalam komposisi yang tetap. Dari sini bisa disimpulkan bahwa penemu dari Atom Modern yaitu John Dalton.
Meskipun sebelumnya ada orang yang mencetuskan mengenai atom tetapi John Dalton berhasil membuktikan mengenai keberadaan atom tersebut melalui sebuah eksperimen sehingga ia bisa dikatakan sebagai penemu dari teori atom modern.
Model Teori Atom
Teori Atom Dalton
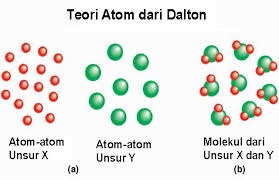
- Setiap unsur tersusun dari partikel yang sangat teramat kecil yang disebut atom.
- Semua atom dari satu unsur yang sama adalah identik, namun atom unsur satu berbeda dengan atom unsur-unsur lainnya.
- Atom dari satu unsur tidak dapat diubah menjadi atom dari unsur lain melalui reaksi kimia; atom tidak dapat diciptakan ataupun dimusnahkan dalam reaksi kimia.
- Senyawa terbentuk dari kombinasi atom-atom dari unsur-unsur yang berbeda dengan rasio atom yang spesifik.
Teori Atom J.J. Thomson
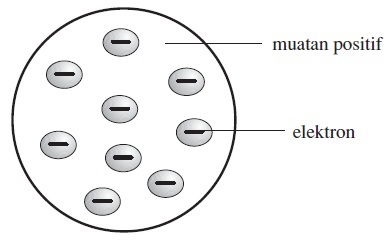
Pada tahun 1897, J.J. Thomson melakukan eksperimen dengan sinar katoda. Eksperimen tersebut menunjukkan bahwa sinar katoda terdefleksi (terbelokkan) oleh medan magnet maupun medan listrik.
Hal ini menunjukkan bahwa sinar katoda merupakan radiasi partikel yang bermuatan listrik.
Pada eksperimen dengan medan listrik, sinar katoda terbelokkan menuju ke arah kutub bermuatan positif.
Hal ini menunjukkan bahwa sinar katoda merupakan radiasi partikel bermuatan negatif.
Selanjutnya, partikel sinar katoda ini disebut sebagai elektron. Penemuan elektron ini kemudian mengacu pada kesimpulan bahwa di dalam atom terdapat elektron yang bermuatan negatif.
Menurut model atom Thomson, elektron bermuatan negatif tersebar dalam bola bermuatan positif seperti model roti kismis, di mana kismis-kismis adalah elektron-elektron, dan roti adalah bola bermuatan positif.
Teori Atom Rutherford
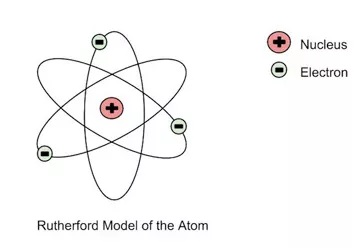
Pada tahun 1911, Ernest Rutherford melakukan eksperimen menembakkan partikel αlpha partikel bermuatan positif pada lempeng emas tipis.
Ia menemukan bahwa sebagian besar partikel-partikel αlpha tersebut menembus melewati lempeng emas, namun ada sebagian yang mengalami pembelokan bahkan terpantulkan.
Hal ini mengacu pada kesimpulan model atom Rutherford model inti, di mana dalam atom.
Sebagian besar merupakan ruang kosong terdapat inti yang padat pejal dan masif bermuatan positif yang disebut sebagai inti atom dan elektron-elektron bermuatan negatif yang mengitari inti atom.
Teori Atom Bohr
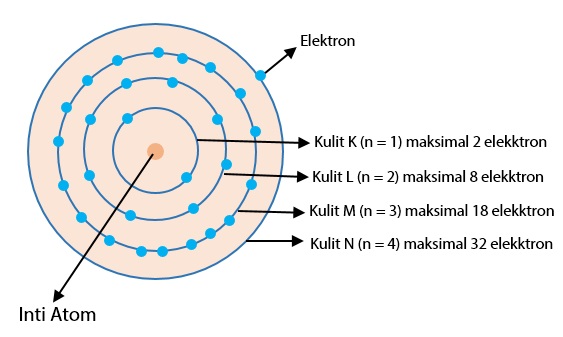
Pada tahun 1913, Niels Bohr mengajukan model atom untuk menjelaskan fenomena penampakan sinar dari unsur-unsur ketika dikenakan pada nyala api ataupun tegangan listrik tinggi.
Model atom yang ia ajukan secara khusus merupakan model atom hidrogen untuk menjelaskan fenomena spektrum garis atom hidrogen.
Bohr menyatakan bahwa elektron-elektron bermuatan negatif bergerak mengelilingi inti atom bermuatan positif pada jarak tertentu yang berbeda-beda seperti orbit planet-planet mengitari matahari.
Oleh karena itu, model atom Bohr disebut juga model tata surya. Setiap lintasan orbit elektron berada tingkat energi yang berbeda. Semakin jauh lintasan orbit dari inti, semakin tinggi tingkat energi.
Lintasan orbit elektron ini disebut juga kulit elektron. Ketika elektron jatuh dari orbit yang lebih luar ke orbit yang lebih dalam, sinar yang diradiasikan bergantung pada tingkat energi dari kedua lintasan orbit tersebut.
Teori Atom Mekanika Kuantum
Pada tahun 1924, Louis de Broglie menyatakan hipotesis dualisme partikel-gelombang semua materi dapat memiliki sifat seperti gelombang.
Elektron memiliki sifat seperti partikel dan juga sifat seperti gelombang.
Pada tahun 1926, Erwin Schrödinger merumuskan persamaan matematis yang kini disebut persamaan gelombang Schrödinger, yang memperhitungkan sifat seperti partikel dan seperti gelombang dari elektron.
Pada tahun 1927, Werner Heisenberg mengajukan asas ketidakpastian Heisenberg yang menyatakan bahwa posisi elektron tidak dapat ditentukan secara pasti, namun hanya dapat ditentukan peluang posisinya.
Teori-teori dualisme partikel gelombang, asas ketidakpastian Heisenberg, dan persamaan Schrödinger ini kemudian menjadi dasar dari teori atom mekanika kuantum.
Penyelesaian persamaan Schrödinger menghasilkan fungsi gelombang yang disebut orbital.
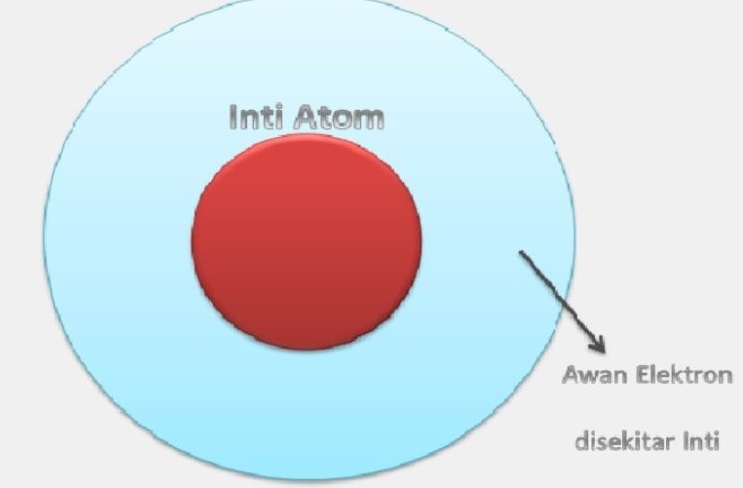
Orbital biasanya digambarkan seperti awan elektron, di mana kerapatan awan tersebut menunjukkan peluang posisi elektron.
Semakin rapat awan elektron maka semakin tinggi peluang elektron, begitu pula sebaliknya.
Oleh karena itu, model atom mekanika kuantum disebut juga model awan elektron.
Sebelumnya, pada tahun 1919, Rutherford berhasil menemukan partikel bermuatan positif, yang disebut proton, dari eksperimen penembakkan partikel α pada atom nitrogen di udara.
Lalu, pada tahun 1932, James Chadwick menemukan partikel netral, yang disebut neutron, dari eksperimen bombardir partikel α pada berbagai unsur.
Dengan demikian, dapat disimpulkan bahwa dalam model awan elektron, awan elektron terdiri dari elektron-elektron bermuatan negatif yang bergerak sangat cepat mengelilingi inti atom yang tersusun dariproton yang bermuatan positif dan neutron yang tak bermuatan.
Perkembangan Teori Atom
Teori Atom modern dikenal juga dengan teori atom mekanika kuantum. Teori mekanika kuantum juga dikenal sebagai prinsip ketidakpastian.
Tidak mungkin dapat ditentukan kedudukan dan momentum suatu benda secara seksama pada saat bersamaan, yang dapat ditentukan adalah kebolehjadian menemukan elektron pada jarak tertentu dari inti atom.
Erwin Schrodinger melengkapi teori mekanika kuantum melalui suatu persamaan untuk mendapatkan fungsi gelombang.
Fungsi gelombang tersebut digunakan untuk menggambarkan batas kemungkinan ditemukannya elektron dalam tiga dimensi.
Schrodinger juga merumuskan bentuk dan tingkat energi orbital. Orbital merupakan daerah ruang di sekitar inti dengan kebolehjadian untuk mendapatkan elektron.
Orbital juga menggambarkan tingkat energi elektron. Orbital-orbital dengan tingkat energi yang sama atau hampir sama akan membentuk sub kulit.
Beberapa sub kulit bergabung membentuk kulit. Kulit terdiri dari beberapa sub kulit dan subkulit terdiri dari beberapa orbital.
Elektron-elektron yang mengelilingi inti atom memiliki tingkat energi tertentu tetapi keberadaannya tidak dapat dipastikan.
Posisi elektron dapat ditemukan melalui fungsi gelombang tertentu dalam kulit atom yang disebut sebagai daerah kebolehjadian paling besar untuk menemukan elektron.
Elektron menempati orbital yang dinyatakan dalam bilangan kuantum. Gerakan elektron memiliki sifat gelombang.
Gerak tersebut mengikuti penyelesaian kuadrat fungsi gelombang yang disebut orbital.
Orbital merupakan bentuk tiga dimensi dari kebolehjadian paling besar ditemukannya elektron dengan keadaan tertentu dalam suatu atom. Orbital juga menggambarkan tingkat energi elektron.
Orbital-orbital dengan tingkat energi yang sama atau hampir sama akan membentuk sub kulit.
Beberapa sub kulit bergabung membentuk kulit. Kulit terdiri dari beberapa sub kulit dan subkulit terdiri dari beberapa orbital.
