Daftar isi
Pada kesempatan kali ini, kita bakal sharing pengetahuan mengenai Konfigurasi Elektron kepada kamu, berikut pembahasannya.
Pengertian Konfigurasi Elektron
Elektron yaitu sebuah partikel sub-atom yang bermuatan negatif dan umumnya dapat ditulis sebagai e-.
Elektron tidak memiliki komponen dasar ataupun substruktur apapun yang diketahui, sehingga ia dapat dipercayai sebagai partikel elementer. Elektron juga memiliki massa sekitar 1/1836 massa proton.
Konfigurasi elektron adalah susunan elektron pada subkulit atom dalam orbital atom atau molekulnya.
Susunan elektron dalam sebuah atom tidak sembarangan, melainkan mengikuti pola atau rumus atau kaidah-kaidah tertentu yang telah di tetapkan oleh para ahli-ahli kimia yang khusus mempelajari tentang konfigurasi elektron ini.
Sejarah Konfigurasi Elektron
Konfigurasi elektron ini pertama kali muncul saat Niels Bohr, mengajukan teori pada sekitar tahun 1923, bahwa periodisitas pada sifat-sifat unsur kimia dapat dijelaskan oleh struktur elektronik atom yang bersangkutan.
Teori ini didasarkan pada sebuah model atom Bohr, yakni Pada saat itu, Bohr telah mencetuskan teori konfigurasi elektron yang memang sangat berbeda dengan yang ada sekarang ini.
Banyak sekali kelemahan yang menyebabkan konfigurasi elektron Bohr ini tidak di gunakan lagi yaitu salah satunya adalah sistem konfigurasi atom Bohr ini tidak dapat menjelaskan tentang perubahan-perubahan spektra atom dalam sebuah medan magnet.

Sistem konfigurasi elektron Bohr ini kemudian di kaji ulang oleh ilmuan yaitu Wolfgang Pauli sehingga kemudian tercetuslah sebuah teori yang disebut larangan pauli.
Aturan Penulisan Konfigurasi Elektron
1. Aturan Aufbau
Dalam prinsip Aufbau, elektron akan stabil jika berada di tingkat energi yang lebih rendah.
Dengan kata lain, elektron suatu atom cenderung menempati sub kulit yang mempunyai tingkat energi lebih rendah. Bagaimana mengetahui besarnya tingkat energi sub kulit?
Caranya adalah dengan mengetahui nilai bilangan kuantum utama atau n serta bilangan kuantum azimut atau l.
Semakin besar nilai (n+l), maka semakin besar nilai tingkat energi suatu orbital. Urutan energi orbital dari yang paling rendah ke yang lebih tinggi adalah sebagai berikut:
1s < 2s < 2p < 3s < 3p < 4s <3d < 4p < 4d …… dan seterusnya.
2. Larangan Pauli
Larangan Pauli disebut juga Eksklusi Pauli. Dalam larangan tersebut dinyatakan bahwa elektron-elektron di dalam satu atom tidak boleh atau tidak bisa memiliki nilai bilangan kuantum yang sama.
Nilai n, l, dan m bisa jadi sama namun nilai bilangan kuantum spin (s) harus berbeda karena dalam orbital hanya boleh terdapat dua elektron yang memiliki spin atau arah putar yang berlawanan.
Larangan Pauli juga menyebutkan bahwa di dalam subkulit s hanya ada 1 orbital dengan jumlah maksimum elektron yaitu 2.
Di dalam subkulit p, terdapat 3 orbital dan jumlah maksimum elektronnya adalah 6.
Subkulit d memiliki 5 orbital dengan jumlah maksimum elektron yaitu 10. Sedangkan orbital f memiliki jumlah orbital sebanyak 7 dengan jumlah maksimum elektron yaitu 14.

3. Aturan Hund
Dalam suatu atom yang memiliki jumlah elektron lebih dari satu, elektron-elektron tersebut akan menyebar dan menempati orbital-orbital sesuai tingkat energi.
Dalam aturan Hund menyatakan bahwa elektron-elektron tersebut tersebar ke seluruh orbital yang memiliki spin yang sama atau sejajar. Dengan begitu elektron akan lebih stabil daripada menyebar secara acak.
Selain itu juga terdapat beberapa penyimpangan yang bisa terjadi pada suatu elektron di dalam atom.
Penyimpangan pertama terjadi pada atom-atom yang berasal gari golongan transisi.
Elektron-elektron cenderung menempati orbital secara penuh atau setengah penuh untuk mencapai kestabilan.
Elektron juga dapat tereksitasi, atau berpindah ke tingkat energi yang lebih tinggi.
Sehingga menghasilkan konfigurasi elektron yang berbeda dari konfigurasi sebelumnya yang lebih stabil.
Peristiwa eksitasi ini terjadi misalnya ketika suatu atom akan berikatan dengan atom lain.
Rumus dan Contoh Soal Konfigurasi Elektron
Soal 1
Buatlah konfigurasi elektron untuk unsur dibawah ini:

Untuk menentukan konfigurasi elektron dari unsur diatas, harus menggunakan nomor atom nya karena pada nomor atom tersebut terdapat nilai proton dan elektron.
Setelah melihat dari aturan penyusun elektron versi simple diatas maka bisa dipahami untuk konfigurasi elektron dari unsur diatas adalah:
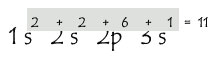
Jumlah dari konfigurasi tersebut harus melihat besaran angka kecil dibelakang.
Jika tadi natrium memiliki elektron 11, maka konfigurasi tersebut sudah benar (2+2+6+1).
Maka hasil dari konfigurasi elektron diatas adalah 1s2 2s2 2p6 3s1.
Maka dari itu, agar bisa mengetahui konfigurasi yang tepat maka harus sekali menghafalkan aturan dasar tersebut.
Menghafal aturan dasar tersebut benar-benar harus tahu persis urutannya dan tidak boleh sampai terbalik atau tertukar.
Setelah itu, barulah lihat soal yang diberikan. Dari sana bisa dilihat berapa jumlah elektron dari unsur yang diberikan.
Contohya tadi jika Natrium atau Na maka jumlah elektronnya adalah 11. Maka konfigurasi elektronnya hanya berhenti sampai 3s1 lantaran sudah mencapai angka 11.
Untuk contoh lainnya, bisa dicoba unsur lainnya. Misalnya unsur Cl atau chlorin. Unsur ini memiliki elektron sebesar 17.
Maka konfigurasi elektronnya adalah 1s2 2s2 2p6 3s2 3p5. Bisa Anda buktikan dengan menjumlah elektronnya yaitu 2+2+6+2+5 = 17.
Soal 2
Tentukan jumlah elektron maksimum dalam suatu atom yang memiliki bilangan kuantum
n = 4, l = 2, dan m = 1.
Jawaban :
n = 4, artinya elektron menempati kulit ke-4
l = 2, artinya elektron menempati subkulit d
m = 1 artinya elektron menempati orbital d yang ke-4
Jadi, dengan bilangan kuantum tersebut, orbital yang dimaksud dapat 3d4 (minimum) atau 3d9 (maksimum).
Sehingga jumlah elektron maksimum dalam atom dengan konfigurasi elektron 1s2 2s2 2p6 3s2 3p6 4s2 3d9 atau 1s2 2s2 2p6 3s2 3p6 4s1 3d10 adalah 29.
Soal 3
Tentukanlah nilai konfigurasi elektron dan jumlah elektron dalam kulit elektron atom unsur dibawah ini :
a. Ni (Z = 28) b. Sr(Z = 38)
Jawaban :
Ni (Z = 28) : 1s2 2s2 2p6 3s2 3p6 4s2 3d8 atau [Ar] 4s2 3d8; K = 2 ; L = 8 ; M = 16 ; N = 2
Sr (Z = 38) : 1s2 2s2 2p6 3s2 3p6 4s2 3d104p6 5s2atau [Kr] 5s2; K = 2 ; L = 8 ; M = 18 ; N = 8 ; O = 2
