Daftar isi
Saat belajar ilmu kimia, atom merupakam substansi dasar yang menyusun materi. Berdasarkan penemuan dan perkembangannya, ada banyak model atom yang dikemukakan oleh beberapa ilmuwan. Ada beberapa model atom dan salah satu yang terkenal adalah model atom Rutherford.
Model atom ini berasal teori atom dengan nama yang sesuai penemunya, yaitu Ernest Rutherford. Buat memahami lebih lanjut mengenai model atom Rutherford berikut beberapa informasi perihal model atom Rutherford beserta kelebihan dan kekurangannya.
Apa Itu Model Atom Rutherford
Teori atom menurut Rutherford dikemukakan berdasarkan eksperimen penembakan ke inti atom berupa lempengan emas serta partikel alfa yang sering disebut sebagai percobaan Geiger-Marsden. Rutherford mencoba menyusun desain rancangan semua percobaan yang berkaitan dengan penembakan atom emas menggunakan partikel alfa dam dipancarkan unsur radioaktif.
Kemudia, sinar radioaktf ternyata ada yang dibelokan, dipantulkan, serta diteruskan. Karena eksperimen menembakan inti atom ke lempengan emas menggunakan partikel alfa sekarang dikenal sebagai percobaan Geiger-Marsden. Sehingga Rutherford memaparkan saat partikel alfa mengenai inti atom, membuat terjadinya tumbukan sehingga menyebabkan adanya pemantulan atau pembelokan partikel alfa.
Itu dikarenakan massa serta muatan atom akan terpusat ke inti (nukleus). Sehingga Rutherford menyarankan jika muatan inti atom akan sebanding massa atom pada satuan massa atom. Kemudian partikel alfa yang menyentuh awan elektron tidak akan dipantulkan ataupun dibelokkan.
Sejarah Penemu Model Atom Rutherford
Model atom Rutherford pertama kali dijelaskan oleh Ernest Rutherford di tahun 1911. Berdasarkan teori atom Rutherford, setiap atom memiliki inti atom yang memiliki muatan positif disertai elektron yang mengitarinya dan tetap pada lintasannya. Tidak hanya itu, massa atom juga akan terpusat ke inti atom sehingga sebagian besar volume pada atom adalah ruang hampa.
Hal ini berhasil dibuktikan berdasarkan hasil percobaan mengenai penembakan logam dengan sinar alpha, atau biasa disebut juga sebagai Percobaan Geiger-Marsden. Hanya saja model atom Rutherford belum bisa memaparkan alasan kenapa elektron tidak alan jatuh ke inti atom.
Tapi menurut teori fisika, berdasrkan gerakan elektron yang mengelilingi inti akan diikuti pemancaran energi. Hal ini yang membuat lama-lama energi elektron berkurang sehingga lintasannya semakin lama mendekat ke inti serta jatuh ke dalam intinya.
Meskipun begitu, Rutherford berhasil memperkenalkan konsep lintasan atau bisa juga disebut kedudukan elektron ataupun kulit atom. Berikut beberapa penemuan yang dinyatakna oleh Rutherford mengenai atom sebagai berikut:
- Atom merupakan sebuah bola berongga yang terdiri atas inti atom disertai elektron yang mengitarinya.
- Inti atom akan memiliki muatan positif. Tidak hanya itu, massa atom juga terpusat pada inti atom.
Model Atom Rutherford
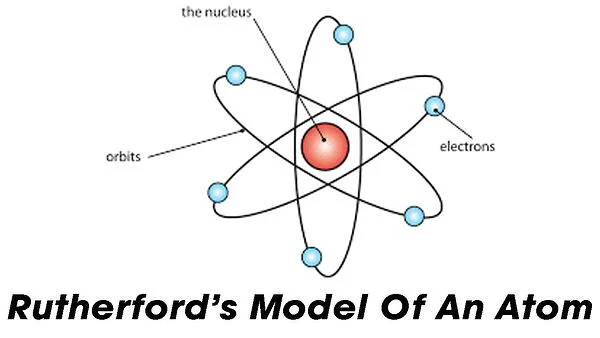
Berdasarkan penelitiannya, Rutherford menyatakan bahwa atom sama persis dengan sistem tata surya, saat matahari dikelilingi oleh planet-planet.
Oleh karena itu, model atom Rutherford sering kali disebut sebagai model atom planet. Beberapa percobaan yang tepat dilakukan oleh Rutherford menghasilkan beberapa teori model atom sebagai berikut:
- Sebagian besar ruangan dalam atom merupakan ruangan kosong.
- Atom terdiri dari inti atom yang bermuatan positif dan hampir seluruh massa atom berpusat pada bagian inti.
- Elektron beredar mengelilingi inti atom dengan kecepatan tinggi
- Jumlah muatan inti sama dengan jumlah muatan elektron yang bersifat netral.
- Sebagian partikel α berhasil lewat tanpa terjadinya pembelokkan ataupun hambatan. Tapi sebagian dibelokkan, ataupun dipantulkan hanya dalam jumlah kecil.
- Awan elektron juga tidak akan mempengaruhi terjadinya penyebaran partikel alfa.
Akibat penemuannya ini, Rutherford dinilai telah berjasa atas pengenalan konsep lintasan atau kedudukan elektron yang kelak disebut dengan kulit atom.
Selain itu adapa beberapa indikator penting didalam pernyataan model atom Rutherford, seperti berikut:
- Awan elektron tidak akan berpengaruh terhadap hamburan partikel alfa.
- Banyaknya muatan positif atom yang terkonsentrasi dengan volume kecil pada pusat atom, serta lebih dikenal sebagai nukleus. Massa atom juga sebanding dengan muatan ini, dengan massa sisanya yanh banyak dipengaruhi neutron. Pusat massa serta muatan terkonsentrasi akan mempengaruhinya serta dalam memantulkan partikel alfa ataupun beta.
- Massa atom beratnya seperti emas yang kebanyakan terkonsentrasi di area pusat muatan, dikarenakan perhitungan menyatakan jika area tidak dipantulkan ataupun bergerak karena adanya partikel alfa dengan kecepatan tinggi, serta mempunyai momentum sangat tinggi daripada elektron, tapi tidak mewakili seluruh berat atom tersebut.
- Atom mempunyai diameter 100.000 (105) kali lebih besar dibandingkan diameter nukleus. Sering diandaikan seperti menaruh sebutir pasir di dalam lapangan sepak bola.
Kelebihan Model Atom Rutherford
Sama seperti teori atom yang lain, model atom Rutherford juga mempunyai beberapa kelebihan seperti berikut :
- Bisa menjelaskan jika terjadi peristiwa penghamburan partikel alfa karena selaput tipis emas.
- Bisa menjelaskan jika keberadaan inti atom bermuatan positif serta menjadi pusat massa atom.
Kekurangan Model Atom Rutherford
Tidak hanya memiliki kelebihan, model atom Rutherford juga mempunyai beberapa kekurang seperti berikut :
- Bertolak belakang terhadap teori mengenai elektron dinamika klasik, dimana suatu partikel yang bermuatan listrik jika bergerak dapat memancarkan energi.
- Elektron yangbbermuatan negatif akan mengelilingi inti dan kehilangan energi secara terus-menerus sampai membentuk suatu lapisan spiral yang jatuh ke inti. Faktanya hal ini tidak bisa terjadi, karena elektron akan tetap stabil di lintasannya.
- Model atom Rutherford juga tidak bisa menjelaskan kenapa elektron tidak bisa jatuh ke inti atomnya.
Itulah beberapa hal mengenai model atom rutherford serta beragam kelebihan dan kekurangannya.
