Daftar isi
Apakah Anda mengerti apa itu tabel periodik kimia? Anda sangat perlu mengetahui dan memahami cara membaca tabel periodik karena materi ini masuk dalam mata kuliah kimia SMA-nya. Sekilas, tabel periodik ini mungkin terlihat rumit, tetapi sangat mudah untuk mengidentifikasi sejumlah besar unsur kimia menggunakan tabel ini.
Pembaca tidak perlu khawatir akan sulitnya memahami tabel unsur kimia ini karena artikel ini membahas tabel periodik secara keseluruhan. Dari definisi, deskripsi, klasifikasi hingga kemudahan membaca tabel periodik sebagai berikut:
Pengertian Tabel Periodik
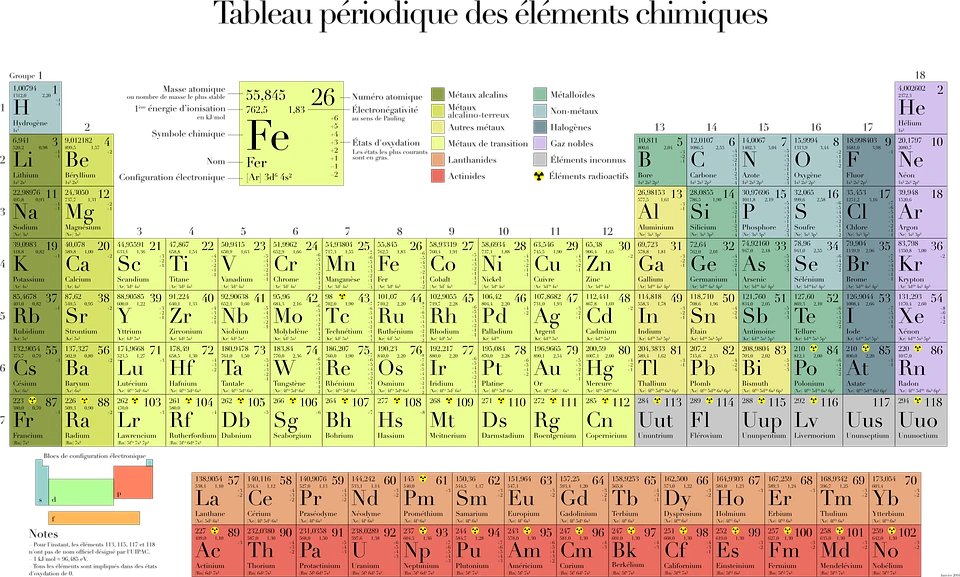
Tabel periodik adalah format tabel yang memuat urutan unsur-unsur kimia berdasarkan nomor atomnya. Nomor atom terurut berisi satu set proton dalam konfigurasi elektron tertentu, yang memiliki sifat yang mirip dengan unsur kimia. Tabel periodik dibagi menjadi empat blok yaitu blok s, p, d dan f. Satu bagian atau baris di sebelah kiri menunjukkan sifat logam, sedangkan yang di sebelah kanan menunjukkan sifat nonlogam.
Istilah Tabel Periodik Grameds perlu diketahui untuk memahami dan membaca unsur kimia dengan arti sebagai berikut:
1. Periode
Periode adalah bagian dari baris horizontal dari tabel periodik kimia yang memiliki kecenderungan horizontal yang lebih tinggi. lebih penting daripada tren vertikal karena sulit dipahami. Grammed melihat di bagian blok-f bahwa lantanida dan aktinida membentuk dua deret horizontal unsur yang secara fundamental penting dalam mendefinisikan kimia unsur.
2. Golongan
Golongan tabel unsur kimia disebut juga famili, yaitu bagian kolom vertikal dari tabel periodik dengan trend periodik yang tidak menggunakan periode dan golongan blok tertentu.
3. Blok S
Blok S tabel periodik kimia adalah unsur-unsur dari dua golongan, yaitu logam alkali dan logam alkali tanah. Dalam komposisinya, blok-s juga mengandung unsur tambahan dengan hidrogen dan helium.
4. Blok-p
Blok-p tabel unsur kimia terdiri dari enam golongan, yaitu golongan 13 sampai 18 menurut aturan IUPAC, yang bervariasi dari 3A sampai 8 A menurut nomenklatur Amerika. Blok-p juga mengandung sebagian besar metaloid.
5. Blok-d
Blok-d pada tabel unsur kimia terdiri dari 3 sampai 12 golongan mulai dari golongan 3B sampai 2B menurut sistem klasifikasi Amerika. Semua unsur kimia golongan-d adalah logam transisi.
6. Blok-f
Blok-f dari tabel unsur kimia sering diletakkan di bawah. Gram harus tahu bahwa gugus blok-f tidak memiliki nomor golongan lantanida dan aktinida.
Unsur dengan nomor atom dari hidrogen hingga oganeson disintesis dan diadaptasi untuk memasukkan unsur-unsur kimia terbaru. Unsur Kimia Nikonium, muscovium, tennessine dan oganesone adalah unsur baru dalam tabel periodik ini. International Union of Pure and Applied Chemistry (IUPAC) secara resmi mengkonfirmasi penambahan unsur-unsur kimia ini pada 30 Desember 2015 dan menamainya pada 28 November 2016.
94 unsur pertama terjadi di alam, tetapi beberapa unsur terbentuk di laboratorium karena tidak ditemukan di alam, misalnya dalam jumlah kecil dan disintesis. Dalam tabel unsur kimia ini, Anda dapat membaca perbandingan penurunan sifat unsur lama dan baru karena belum ditemukan. Tabel periodik kimia menyediakan kerangka kerja unsur kimia yang dapat digunakan untuk membaca dan menganalisis perilaku kimia tertentu.
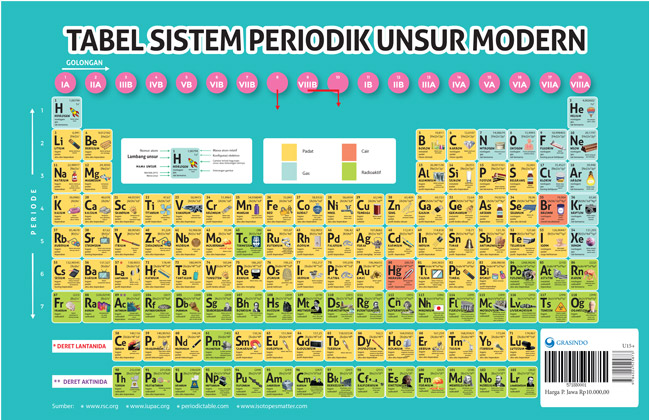
Sejarah Tabel Periodik
Tabel Periodik adalah sebuah tabel yang mengelompokkan unsur-unsur kimia berdasarkan sifat-sifat kimianya. Tabel Periodik pertama kali dikembangkan oleh seorang kimiawan Rusia bernama Dmitry Mendeleev pada tahun 1869.
Pada saat itu, Mendeleev menyusun unsur-unsur kimia berdasarkan massa atomnya. Ia menyadari bahwa setiap unsur memiliki sifat kimia yang unik dan berkaitan dengan posisinya di dalam tabel periodik. Mendeleev juga membuat prediksi mengenai unsur-unsur yang belum ditemukan pada saat itu.
Setelah Mendeleev, para kimiawan lainnya juga mengembangkan tabel periodik dengan mengubah kriteria pengelompokan unsur-unsur. Salah satu kimiawan yang terkenal dengan tabel periodiknya adalah Henry Moseley, yang mengelompokkan unsur-unsur berdasarkan nomor atomnya.
Tabel Periodik yang digunakan saat ini memiliki 118 unsur yang diatur berdasarkan jumlah proton di dalam inti atom (nomor atom) dan konfigurasi elektronnya. Tabel periodik ini terus diperbarui seiring dengan penemuan unsur-unsur baru dan perkembangan ilmu kimia.
Tabel Periodik yang digunakan saat ini memiliki 7 periode dan 18 golongan, yang mengelompokkan unsur-unsur berdasarkan sifat-sifatnya. Periode di tabel periodik menunjukkan jumlah kulit elektron yang dimiliki oleh atom unsur tersebut, sedangkan golongan menunjukkan jumlah elektron valensi yang dimiliki oleh atom unsur.
Unsur-unsur di dalam tabel periodik memiliki sifat-sifat yang berbeda-beda, seperti sifat fisika, kimia, dan radioaktifnya. Sifat-sifat ini memungkinkan unsur-unsur kimia digunakan dalam berbagai aplikasi dan industri, seperti penggunaan logam sebagai bahan bangunan, bahan bakar nuklir, obat-obatan, dan lain sebagainya.
Tabel Periodik juga memiliki beberapa unsur-unsur yang sangat penting, seperti hidrogen, karbon, nitrogen, oksigen, dan unsur-unsur logam seperti besi, tembaga, dan emas. Unsur-unsur ini memainkan peran penting dalam kehidupan kita sehari-hari dan dalam berbagai aplikasi teknologi.
Dengan adanya tabel periodik, para ilmuwan dan kimiawan dapat mempelajari unsur-unsur kimia dengan lebih terorganisir dan lebih mudah. Tabel periodik juga membantu dalam penemuan unsur-unsur baru dan pengembangan aplikasi baru untuk unsur-unsur tersebut. Oleh karena itu, tabel periodik merupakan salah satu alat terpenting dalam ilmu kimia dan memiliki peran yang sangat penting dalam kemajuan ilmu pengetahuan dan teknologi.
Fungsi Tabel Periodik
Tabel periodik memiliki banyak fungsi dalam ilmu kimia dan aplikasinya di dunia nyata. Berikut adalah beberapa fungsi utama dari tabel periodik:
1. Mengelompokkan Unsur-unsur
Tabel periodik mengelompokkan unsur-unsur kimia berdasarkan sifat-sifatnya seperti jumlah proton di inti atom, konfigurasi elektron, dan sifat-sifat kimia lainnya. Hal ini memudahkan para kimiawan dan ilmuwan dalam memahami karakteristik dan sifat-sifat unsur-unsur yang berbeda.
2. Memprediksi Sifat-sifat Unsur
Dengan menggunakan tabel periodik, para ilmuwan dapat memprediksi sifat-sifat kimia dan fisika dari unsur-unsur yang belum ditemukan atau belum teridentifikasi.
3. Membantu dalam Penemuan Unsur-unsur Baru
Tabel periodik dapat membantu para ilmuwan dalam mencari unsur-unsur baru, terutama melalui analisis data spektroskopi dan metode penemuan baru lainnya.
4. Membantu dalam Penentuan Sifat-sifat Unsur
Tabel periodik dapat digunakan untuk menentukan sifat-sifat kimia dan fisika dari unsur-unsur, seperti titik lebur, titik didih, keelektronegatifan, reaktivitas, dan lain-lain.
5. Membantu dalam Pengembangan Teknologi
Tabel periodik juga berfungsi sebagai panduan dalam pengembangan aplikasi dan teknologi yang menggunakan unsur-unsur kimia, seperti bahan bangunan, bahan bakar nuklir, obat-obatan, dan lain-lain.
Dalam rangka memahami dan memanfaatkan tabel periodik dengan maksimal, para ilmuwan dan kimiawan perlu memiliki pemahaman yang kuat tentang unsur-unsur dan sifat-sifat kimia mereka.
Keterangan Tabel Periodik
- Tabel tersebut memiliki baris yang menunjukkan titik dan kolom yang menunjukkan kelompok unsur kimia.
- Ada 6 golongan atau kumpulan dalam tabel yang namanya bukan angka. Misalnya, unsur golongan 17 adalah halogen dan gas mulia golongan 18
- Tabel unsur kimia ini dapat digunakan untuk memperoleh hubungan antara sifat unsur dan memprediksi sifat unsur yang baru ditemukan
- Tabel ini menyediakan kerangka kerja untuk menganalisis perilaku unsur tertentu elemen unsur kimia banyak digunakan dalam bidang penelitian kimia
Klasifikasi Tabel Periodik
Unsur kimia dikelompokkan berdasarkan sifat fisika dan kimianya sesuai dengan gejala yang dialami unsur tersebut. Oleh karena itu, ada beberapa klasifikasi yang harus diketahui untuk memahami tabel periodik dengan baik, seperti:
1. Sifat Umum
Secara umum, unsur kimia memiliki sifat fisik dan kimia yang terdiri dari tiga kategori, yaitu logam, metaloid, dan nonlogam. Berikut penjelasan lengkap sifat umum unsur kimia:
a. Logam. Biasanya berupa padatan mengkilap dengan konduktivitas tinggi dan dapat membentuk paduan dengan bentuk logam lain, membentuk senyawa ionik dalam bentuk garam dengan bukan logam atau gas mulia. Berikut adalah sifat-sifat logam dalam tabel periodik
- 78% dari semua unsur yang diketahui adalah logam
- Diletakkan di sebelah kiri tabel periodik
- Biasanya padat pada suhu kamar
- Biasanya titik beku dan titik didih tinggi
- Penghantar panas dan listrik yang baik
- Dapat ditempa dan diregangkan
b. Nonlogam. Biasanya gas berwarna atau tidak berwarna yang secara kovalen dapat membentuk senyawa dengan nonlogam lainnya. Sifat-sifat nonlogam pada tabel periodik adalah:
- Terletak di sisi kanan tabel periodik
- Total ada 22 nonlogam
- Biasanya padat atau gas pada suhu kamar
- Titik beku dan titik didih rendah
- Penghantar panas dan listrik yang buruk
c . Metaloid. Biasanya logam menengah dan bukan logam atau campuran dari dua unsur
Klasifikasi tabel periodik biasanya ditunjukkan dengan warna yang berbeda pada tabel. Membatasi unsur logam dan nonlogam dengan jumlah logam dan nonlogam dalam unsur kimia. Logam dan nonlogam diklasifikasikan lebih lanjut ke dalam subkategori dengan sifat bervariasi dari nonlogam hingga unsur kimia dalam periode yang sama.
Logam terdiri dari alkali reaktif, logam alkali tanah kurang reaktif, aktinida ylantanida, logam transisi dan logam pasca transisi. Nonlogam terdiri dari nonlogam esensial poliatomik, yang hampir seperti metaloid, dan gas mulia monoatomik, yang hampir seluruhnya nonlogam inert. Ketika metaloid memiliki lebih banyak sifat logam dan non-logam seperti silikon, germanium, arsenik dan antimon.
2. Keadaan Materi
Masalah lain yang juga mempengaruhi klasifikasi unsur kimia adalah keadaan materi atau fasa unsur, seperti cair, padat atau gas pada suhu dan tekanan konstan (STP). Secara umum, unsur-unsur berada dalam keadaan padat pada suhu kamar dan tekanan atmosfer, dan ada pula yang dalam keadaan gas. Sementara itu, hanya bromin dan merkuri yang berbentuk cair pada tekanan atmosfer normal pada 0 ◦C atau sekitar 32 ◦F.
3. Titik Lebur dan Titik Didih
Titik lebur dan titik didih digunakan untuk menentukan sifat unsur dalam derajat Celcius pada tekanan atmosfer tertentu. Sebenarnya klasifikasi unsur berdasarkan titik leleh dan titik didihnya sudah diketahui, namun ada beberapa unsur radioaktif yang sangat kecil yang belum diketahui. Helium atau He dalam penyajian konvensional hanya memiliki titik didih dan tidak memiliki titik leleh karena tetap dalam keadaan cair bahkan pada tekanan nol mutlak.
4. Massa Jenis
Massa jenis pada suhu dan tekanan konstan (STP) juga sering digunakan dalam klasifikasi tabel periodik sebagai sifat suatu unsur kimia. Massa jenis kemudian dinyatakan dalam gram per sentimeter kubik atau g/cm3. Kepadatan juga biasanya dilaporkan untuk keadaan gas pada suhu pengukuran ruangan tertentu. Misalnya, ketika dicairkan atau dipadatkan, unsur gas memiliki kerapatan yang sama dengan unsur kimia lainnya.
Jika suatu unsur kimia memiliki alotrop dengan kerapatan berbeda, salah satu alotrop tipikal dipilih saat menyajikan kesimpulan. Kepadatan masing-masing alotrop dapat dijelaskan secara rinci. Misalnya, tiga alotrop karbon, yaitu karbon amorf, grafit, intan, memiliki kerapatan yang sesuai, yaitu 1,8-2,1; 2267; dan 3,515 g/cm3.
5. Struktur Kristal
Anda harus mengetahui bahwa ada delapan jenis struktur kristal dalam bahan unsur kimia yang selama ini dipelajari sebagai sampel padat. Yakni, kubus, kubus berpusat badan, kubus berpusat muka, heksagonal, monoklinik, ortorombik, rhombohedral dan tetrahedral. Pada beberapa unsur transuranik sintetik, unsur kimia dalam sampel terlalu kecil untuk menentukan struktur kristalnya.
6. Asal Usulnya dari Bumi
94 unsur pertama terbentuk secara alami, sedangkan 24 unsur sisanya disintesis secara artifisial sebagai produk reaksi nuklir buatan. Terdapat 83 unsur kimia yang dianggap primordial dan permanen atau radioaktif lemah. 11 elemen yang tersisa dianggap sebagai elemen fana karena mereka memiliki waktu paruh yang pendek di tata surya awal. 11 unsur tersebut adalah polonium, radon, radium, aktinium, dan protaktinium.
Unsur tersebut adalah bahan peluruhan torium, dan 6 unsur lainnya adalah unsur berumur pendek lainnya yang diproses oleh reaksi nuklir langka yang melibatkan titanium atau unsur barat. Unsur-unsur yang tersisa adalah texinium, astatine, promethium, neptunium, fransium dan plutonium.
Cara Membaca Tabel Periodik
Sekarang Anda telah memahami arti dan deskripsi tabel periodik kimia, dia perlu mengetahui cara membaca tabel periodik karena untuk mendefinisikan unsur-unsur kimia dengan benar. Ada beberapa tips membacanya untuk memahami hal-hal berikut:
1. Membaca Tabel Periodik dari Kiri Atas ke Kanan Bawah
Tabel unsur kimia ini diurutkan berdasarkan nomor atom, jadi semakin jauh ke kanan dan ke bawah, nomor atomnya. Semakin meningkat Nomor atom pada tabel periodik adalah jumlah proton dalam atom suatu unsur kimia, dan nomor massa atom yang lebih tinggi berada di sebelah kanan. Anda memahami berat suatu unsur kimia tertentu, bahkan jika itu hanya posisinya pada tabel periodik kimia.
Tabel periodik di kanan dan di bawah menunjukkan berat atom suatu unsur kimia dalam urutan menaik, karena dihitung dengan jumlah proton dan neutron dalam setiap atom unsur kimia tersebut. Jumlahnya terus bertambah karena jumlah proton juga bertambah, sedangkan bahan elektron memiliki pengaruh yang kecil terhadap massa atom.
2. Pahami Unsur Kimia
Setiap unsur kimia harus mengandung 1 proton lebih banyak dari atom di sebelah kiri tabel periodik. Anda melihat nomor atom dari kiri ke kanan. Unsur-unsur kimia ini dibagi menjadi 3 golongan, misalnya barisan pertama mengandung hidrogen dengan nomor atom 1 dan helium dengan nomor atom 2.
Jadi Anda dapat mendefinisikan bahwa kedua unsur ini berada di ujung kiri dan kanan tabel periodik. karena mereka berada di grup yang sama, berbeda.
3. Identifikasi Golongan Atom dengan Sifat Fisik yang Mirip
Golongan dalam tabel periodik diperlihatkan sebagai kolom vertikal dan golongan tersebut ditandai dengan jumlah warna yang sama. Para astronom dapat menggunakan warna-warna ini untuk membantu mengidentifikasi unsur mana yang memiliki sifat fisik dan kimia yang serupa.
Dengan demikian, reaksi unsur-unsur kimia dalam setiap golongan lebih mudah diprediksi walaupun dengan jumlah elektron yang sama. Semua unsur kimia hanya termasuk dalam satu golongan, kecuali hidrogen, yang termasuk golongan halogen atau logam alkali. Unsur kimia hidrogen bahkan ditemukan di kedua kelompok tabel periodik.
4. Perhatikan Ruang Kosong pada Tabel
Anda juga harus memperhatikan penempatan unsur-unsur dalam golongan dan golongan untuk menilai sifat fisika dan kimia yang sama. Metode ini memudahkan Grameds untuk memahami setiap elemen responsif.
Seiring bertambahnya ukuran unsur-unsur kimia, klasifikasi juga menjadi lebih sulit, itulah sebabnya ada ruang kosong di tabel untuk unsur-unsur kimia tersebut. Misalnya, tiga baris pertama tabel memiliki ruang kosong karena bekerja untuk logam transisi dalam tabel periodik, yaitu nomor atom 21.
5. Perhatikan Bahwa Setiap Baris Disebut Periode
Semua unsur kimia dalam satu periode harus memiliki jumlah putaran atom yang sama agar elektron tertentu melewatinya. Jumlah orbital ini sesuai dengan jumlah periode dalam tabel periodik, menunjukkan 7 baris, yang berarti 7 periode. Misalnya, unsur periode 1 memiliki 1 orbital, sedangkan unsur periode 7 juga memiliki 7 orbital. Contohnya diberi nomor 1-7 dari atas ke bawah di sisi kiri tabel periodik.
6. Perbedaan Logam, Semilogam, dan Nonlogam
Ahli tata bahasa perlu mengetahui jenis-jenis unsur agar lebih mudah memahami sifat-sifat unsur-unsur dalam tabel periodik. Klasifikasi warna tabel periodik ini menunjukkan apakah suatu unsur termasuk dalam kelompok logam, semilogam, atau nonlogam. Ahli tata bahasa dapat melihat perbedaannya untuk menemukan unsur logam di sisi kanan tabel, sedangkan unsur kimia nonlogam ada di kiri, dan gugus semilogam antara logam dan nonlogam.
